
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)?
B.c(CH3COO-)+c(CH3COOH)=n mol·L-1?
C.CH3COOH的存在对CH3COONa的水解有促进作用?
D.CH3COOH的电离程度小于CH3COONa的水解程度?
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:阅读理解
 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0.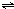 CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
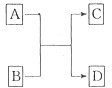 (2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题: →
→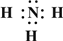
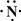 →
→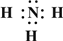


查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-) |
| n(HSO3-) |
|
91:9 | 1:1 | 9:91 | ||
| 室温下pH | 8.2 | 7.2 | 6.2 |
| n(SO32-) |
| n(HSO3-) |
查看答案和解析>>
科目:高中化学 来源:高一化学 第3章 有机化合物的获得与应用 3.1.1 天然气的利用 甲烷(苏教版必修2) 苏教版 题型:022
在烷烃分子中的基团:-CH3、-CH2-、![]() 中的碳原子分别为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,如
中的碳原子分别为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,如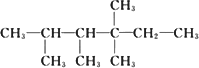 ,分子中n1=6,n2=1,n3=2,n4=1.相应的碳原子上的氢分别用伯氢、仲氢、叔氢加以区别,如下面所示:
,分子中n1=6,n2=1,n3=2,n4=1.相应的碳原子上的氢分别用伯氢、仲氢、叔氢加以区别,如下面所示:

(1)四种碳原子数之间的关系为n1=________.
(2)如果某烷烃分子中间时存在这四种基团,最少应为含有________个碳原子的烷烃,其结构简式有________种,它们分别是________.
(3)在烷烃的取代反应中,伯、仲、叔三种氢原子被取代的几率(机会)不同,但同类氢原子被取代的几率(机会)可视为相同.现将n mol 2-甲基丁烷(![]() )与适量溴代物和________mol HBr.若在上述溴的取代反应中,伯、仲、叔氢原子被溴原子取代的几率比为a∶b∶c,则生成的4种一溴代物中
)与适量溴代物和________mol HBr.若在上述溴的取代反应中,伯、仲、叔氢原子被溴原子取代的几率比为a∶b∶c,则生成的4种一溴代物中![]() Br所占的物质的量分数为________.
Br所占的物质的量分数为________.
查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com