
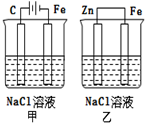
| A. | 甲装置是牺牲阳极的阴极保护法 | |
| B. | 乙装置是牺牲阳极的阴极保护法 | |
| C. | 一段时间后甲、乙装置中pH均增大 | |
| D. | 甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑ |
分析 甲装置中C为阳极,阳极上氯离子失电子,Fe为阴极,阴极上氢离子得电子;乙装置中Zn为负极,Fe为正极,正极上氧气得电子,据此分析.
解答 解:A.甲装置中C为阳极,阳极上氯离子失电子,Fe为阴极,阴极上氢离子得电子,属于外加电源的阴极保护法,故A错误;
B.乙装置中Zn为负极,Fe为正极,正极上氧气得电子,Fe不参加反应,Fe被保护,所以是牺牲阳极的阴极保护法,故B正确;
C.甲装置中电解氯化钠生成氢氧化钠,溶液的pH增大,乙装置中负极Zn失电子,正极氧气得电子,最终生成氢氧化锌,溶液的pH几乎不变,故C错误;
D.乙中正极上氧气得电子生成氢氧根离子,所以Fe电极上没有氢气生成,故D错误.
故选B.
点评 本题考查了金属的腐蚀与防护问题,注意根据原电池、电解原理分析,题目难度不大,侧重于考查基础知识的考查,注意把握电极方程式的书写方法.


科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:实验题
(1)配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外还需 和 ;
(2)用托盘天平准确称量 g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待 后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯2-3次,洗涤后的溶液 ,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面 时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,倒转摇匀,装入细口瓶贴上标签;
(6)下列情况多所配制浓度有何影响? (用偏大、偏小、无影响填写)
A. 所用的固体NaOH长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.Fe2O3+3CO=2Fe+3CO2ΔH=-24.8 kJ•mol-1(反应热)
B.CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ•mol-1(反应热)
C.C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658.0 kJ•mol-1(燃烧热)
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3 kJ•mol-1(中和热)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和氢氧化亚铁反应的离子方程式:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 在酸性溶液中,Na+、K+、MnO4-、Br-能大量共存 | |
| D. | 除去Mg2+溶液中的少量Al3+,可以采用加入足量的氢氧化钠后过滤、再加酸的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
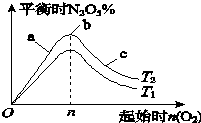 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠加入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 铁粉加入到FeCl3溶液中:Fe+2Fe3+═3Fe2+ | |
| C. | 金属铝加入到NaOH溶液中:Al+2OH-+H2O═AlO2-+2H2↑ | |
| D. | 铜片插入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LH2O所含分子数为0.5NA | |
| B. | 1mol•L-1CaCl2溶液中所含Ca2+离子的数目为NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 0.1molZn与含0.1molHCl的盐酸溶液充分反应,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O | B. | 硫酸 | C. | NaOH(s) | D. | Na2SO4(s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com