
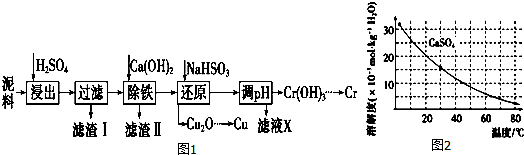
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
分析 污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,在污泥中加入硫酸酸浸,过滤,在滤液中加入熟石灰调节溶液PH沉淀铁离子,加入亚硫酸氢钠还原得到氧化亚铜,用来制备铜,加入氢氧化钙调节溶液PH得到氢氧化铬,得到金属铬,
(1)根据氧化铜和硫酸反应生成硫酸铜和水进行解答,向电镀污泥中加入硫酸,氧化铁、CuO、Cr2O3都与硫酸反应生成硫酸铁、硫酸铜和硫酸铬;
(2)根据图表可知铁离子完全沉淀pH为3.2,Cr3+开始沉淀PH=4.3,所以在除铁操作中,需要除去Fe3+和CaSO4,硫酸钙溶解度随升高温度减小,易于除去;
(3)亚硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜,过量的碳酸氢根离子和酸反应会生成二氧化硫气体;
(4)根据Ksp[Cr(OH)3]=c(Cr3+)•(OH-)3来计算回答.
解答 解:(1)向电镀污泥中加入硫酸,氧化铁、CuO、Cr2O3都与硫酸反应生成硫酸铁、硫酸铜和硫酸铬,滤渣Ⅰ是难溶杂质,氧化铜和硫酸反应生成硫酸铜和水,所以在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有硫酸铜,
故答案为:CuSO4;
(2)根据图表可知铁离子完全沉淀pH为3.2,Cr3+开始沉淀PH=4.3,所以在除铁操作中,需要除去Fe3+和CaSO4,相关操作:
①加入石灰乳调节pH到3.2~4.3,检验Fe3+已经除尽的操作是:取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除,
故答案为:3.2~4.3;取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80,为避免溶质损失,硫酸钙溶解度随温度升高减小,需要趁热过滤,
故答案为:趁热过滤;
(3)硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜,发生的反应为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,在酸性环境下,亚硫酸氢根离子和氢离子之间反应生成的二氧化硫具有毒性,能污染空气,
故答案为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+;产生SO2污染环境;
(4)当离子浓度≤1×10-5 mol•L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥=$\root{3}{\frac{Ksp}{c(C{r}^{3+})}}$=$\root{3}{\frac{6.3×1{0}^{-31}}{1×1{0}^{-5}}}$=4.0×10-9 mol•L-1,
故答案为:4.0×10-9 mol•L-1.
点评 本题考查了离子方程式的书写、物质的分离等知识点,题目难度中等,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 480mL容量瓶,7.68g硫酸铜 | B. | 480mL容量瓶,12.0g胆矾 | ||
| C. | 500mL容量瓶,12.5g硫酸铜 | D. | 500mL容量瓶,12.5g胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线) | |
| B. | 尿毒症患者使用血液透析治疗 | |
| C. | 明矾净水 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com