
分析 (1)铝热剂直接与H2SO4作用时产生气体的反应:2Al+3H2SO4=Al2(SO4)3+3H2↑,根据氢气的量可以求出Al 的质量;
铝热反应后的混合物遇NaOH能放出H2,表明铝热反应Al剩余,则:2Al+2NaOH+6H2O=2Na[Al(HO)4]+3H2↑,根据氢气的量求出Al的量,根据发生铝热反应的铝量结合方程式计算出Fe3O4的质量;
(2)加NaOH溶液后Al元素全部转化为NaAlO2,根据元素守恒计算NaOH;加HCl后生成FeCl2和AlCl3,根据元素守恒计算消耗的HCl;发生铝热反应后,混合固体为Al、Al2O3和Fe,根据方程式计算氢气的体积V.
解答 解:(1)铝热剂直接与H2SO4作用时产生气体的反应:
2Al+3H2SO4=Al2(SO4)3 +3H2↑
54.0 g 67.2 L
m(Al) 3.36 L
解得:m(Al)=$\frac{54g×3.36L}{67.2L}$=2.70g,
铝热反应后的混合物遇NaOH能放出H2,表明铝热反应Al剩余,则:
2Al+2NaOH+6H2O=2Na[Al(HO)4]+3H2↑
54.0g 67.2 L
m(Al) 0.336L
解得:m余(Al)=0.540 g
铝热剂中Fe3O4的质量:
3Fe3O4 +8Al $\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe
696 g 216 g
m(Fe3O4) 2.70g-0.540g
则:m(Fe3O4)=$\frac{(2.70g-0.540g)×696g}{216g}$=6.96 g
则:w(Al)=$\frac{2.7g}{6.96g+2.7g}$×100%=28%,
ww(Fe3O4)=$\frac{6.96g}{6.96g+2.7g}$×100%=72%;
答:铝热剂中铝的质量分数为28%,Fe3O4的质量分数为72%.
(2)加NaOH溶液后Al元素全部转化为NaAlO2,n(NaOH)=n(Al)=$\frac{2.7g}{54g/mol}$=0.05mol;
加HCl后生成FeCl2和AlCl3,n(HCl)=2n(FeCl2)+3n(AlCl3)=$\frac{6.96}{232}$mol×3×2+0.05mol×3=0.33mol,
Al与Hcl反应生成的氢气为0.336L,Fe+2HCl=FeCl2+H2↑,则n(H2)=n(Fe)=$\frac{6.96}{232}$mol×3=0.09mol,所以V=0.336L+0.09mol×22.4L/mol=2.352L;
答:m=0.05mol,n=0.33mol,V=2.352L.
点评 本题考查化学方程式计算,题目难度中等,注意利用原子守恒进行解答,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 化合物 | B. | 氧化物 | C. | 无机物 | D. | 钾盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.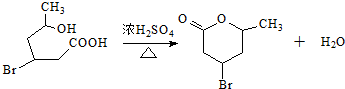 .
. (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为HCHO、CH3COCHO,它们物质的量之比是2:1.
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为HCHO、CH3COCHO,它们物质的量之比是2:1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
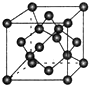 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com