
阅读分析材料,据此完成下列要求
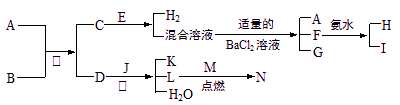 A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系
A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系
其中,A是生活的必需品,其焰色反应呈黄色;B为二元强酸;D为氢化物;E在地壳中的含量居第三位,其单质大量用于制造导线和合金;J是普通干电池的重要成分;C为酸式盐;F的水溶液与少量的过氧化钠反应也可得到I;G是一种不溶于稀硝酸的白色沉淀;M在L气体中燃烧产生棕黄色烟。
⑴A的晶体类型为 ,C的化学式为 。
⑵M的化学式为 ;若N的水溶液呈蓝绿色,则M与B反应的化学方程
式为: 。
⑶D的浓溶液与J反应的离子方程式为: 。F的水溶液与过量的过氧化钠反应的离子方程式为: 。
⑷H溶液中各离子浓度由小到大的顺序为 。
(15分)
![]() (1)离子晶体(2分) NaHSO4(2分)
(1)离子晶体(2分) NaHSO4(2分)
![]() (2)Fe(或Cu) (2分) Cu+2H2SO4(浓) CuSO4+SO2↑+H2O(2分)
(2)Fe(或Cu) (2分) Cu+2H2SO4(浓) CuSO4+SO2↑+H2O(2分)
(3)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分)
(4)c(OH-)<c(H+)<c(NH4+)<c(Cl-) (3分)
本题是典型的无机推断,只要推出物质问题很好解决了!A NaCl;B H2SO4;C NaHSO4;D HCl;J MnO2;K MnCl2;L Cl2;M Cu或Fe;N CuCl2或FeCl3;F AlCl3;G BaSO4; H NH4Cl;I Al(OH)3其他问题就很容易解决了


科目:高中化学 来源: 题型:阅读理解
阅读分析材料,据此完成下列要求
短周期元素A、B、C、D、E、F,它们的原子序数依次增大,其中B和C为同一周期;D、E、F为同一周期;A和D、C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2、X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(9分)阅读分析材料,据此完成下列要求:
短周期元素A.B.C.D.E.F,它们的原子序数依次增大,其中B和C为同一周期;D.E.F为同一周期;A和D.C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2.X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2014届吉林省松原市高二下期中考试化学卷(解析版) 题型:填空题
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值。注意阅读分析材料,据此完成下列要求。
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
(1)预测周期表中电负性最大的元素应为 (填元素符号);估计钙元素的电负性的取值范围: <X< 。
(2)简述元素电负性X的大小与元素金属性、非金属性之间的关系
。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为 ;上表中最易形成离子键的两种元素的电负性之差为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖南嘉禾一中高三1月份高考押题化学试卷 题型:填空题
(9分)阅读分析材料,据此完成下列要求:
短周期元素A.B.C.D.E.F,它们的原子序数依次增大,其中B和C为同一周期;D.E.F为同一周期;A和D.C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2.X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读分析材料,据此完成下列要求:
短周期元素A.B.C.D.E.F,它们的原子序数依次增大,其中B和C为同一周期;D.E.F为同一周期;A和D.C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2.X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com