
| A. | 在浓硫酸作用下,60g冰醋酸与足量无水乙醇反应生成乙酸乙酯的分子数为NA | |
| B. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| C. | 电解精炼铜,当外电路转移NA个电子时,阳极质量减少32g | |
| D. | 含0.01molFeCl3的浓溶液滴入沸水,制得的胶体粒子数目小于0.01NA |
分析 A.酯化反应是可逆反应进行分析判断;
B.3.36LC2H4和C3H6的混合气体物质的量=$\frac{3.36L}{22.4L/mol}$=0.15mol,烯烃分子中含碳碳双键;
C.电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属杂质;
D.0.01mol FeCl3滴入沸水形成的氢氧化铁胶体,氢氧化铁胶体粒子为氢氧化铁的聚集体.
解答 解:A.60g冰醋酸与足量乙醇发生酯化反应,应为酯化反应为可逆反应,所以生成乙酸乙酯的分子数小于1NA,故A错误;
B.3.36LC2H4和C3H6的混合气体物质的量=$\frac{3.36L}{22.4L/mol}$=0.15mol,若C3H6为烯烃,烯烃分子中含碳碳双键0.15NA,C3H6也可以为环烷烃,故B错误;
C.电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属杂质,故当转移NA个电子时,阳极减少的质量小于32g,故C错误;
D.氢氧化铁胶粒为氢氧化铁的聚集体,含0.01molFeCl3的浓溶液滴入沸水,制得的胶体粒子数目小于0.01NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确电解原理、酯化反应、氢氧化铁胶体为氢氧化铁的聚集体,注意可逆反应的特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
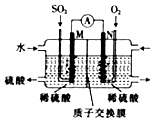 某兴趣小组用电化学法模拟工业处理SO2.强硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验.下列说法正确的是( )
某兴趣小组用电化学法模拟工业处理SO2.强硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验.下列说法正确的是( )| A. | N极为负极 | |
| B. | 反应一段时间后,左侧电解质溶液的pH增大 | |
| C. | M极发生的电极反应为SO2+2H2O-2e-═SO42-+4H+ | |
| D. | 在相同条件下,M、N两极上消耗的气体体积之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实际应用 | 相应性质 | |
| A | 用含有酸性重铬酸钾溶液的仪器检验酒后驾车 | 乙醇具有还原性 |
| B | 明矾常用于自来水的净化、杀菌消毒 | 明矾可发生水解生成胶状的Al(OH)3 |
| C | BaSO4可作为造影剂检查肠胃道疾病 | BaSO4难溶于水且不与盐酸反应 |
| D | 过氧化钠可用作呼吸面具中的供氧剂 | Na2O2能与CO2反应生成O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于分子晶体.
;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| B. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 氯苯分子中所有原子都处于同一平面 | |
| D. | 甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | HY | C. | Y2 O | D. | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,由水电离出c(OH-)=1×10-12 mol•L-1的溶液中:K+、HCO3-、Na+、Cl- | |
| B. | 含有0.1 mol•L-1 Fe2+的溶液中:NH4+、SO42-、H+、NO3- | |
| C. | 使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 室温下,pH=1的溶液中:Na+、Cl-、K+、CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com