
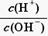 =1010,请回答下列问题:
=1010,请回答下列问题:A.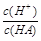 | B.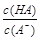 | C.c(H+)·c(OH-) | D.c(OH-) |
 H++A-
H++A-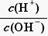 =1010得c(H+)="0.01" mol·L-1,c(HA)=" 0.1" mol·L-1,所以HA是弱酸。
=1010得c(H+)="0.01" mol·L-1,c(HA)=" 0.1" mol·L-1,所以HA是弱酸。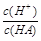 =
=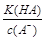 ,稀释HA的过程中,c(A-)减小、K(HA)不变,
,稀释HA的过程中,c(A-)减小、K(HA)不变,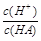 增大,A错误;
增大,A错误;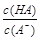 =
=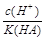 ,稀释过程中c(H+)减小、K(HA)不变,
,稀释过程中c(H+)减小、K(HA)不变,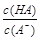 减小,B正确;c(H+)·c(OH-)=Kw,Kw随温度变化而变化,c(H+)·c(OH-)不变,C错误;稀释HA过程中,c(H+)减小、c(OH-)增大,D错误。
减小,B正确;c(H+)·c(OH-)=Kw,Kw随温度变化而变化,c(H+)·c(OH-)不变,C错误;稀释HA过程中,c(H+)减小、c(OH-)增大,D错误。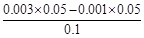 =0.001mol/L,c(H+)=10-9mol/L,pH=9。
=0.001mol/L,c(H+)=10-9mol/L,pH=9。

科目:高中化学 来源:不详 题型:单选题
| A.PH=3的盐酸和PH=11的氨水等体积混合 |
| B.PH=3的盐酸和PH=11的氢氧化钡等体积混合 |
| C.PH=3的醋酸和PH=11的氢氧化钡等体积混合 |
| D.PH=3的硫酸和PH=11的氨水等体积混合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.V(酸)=102V(碱) | B.V(碱)=102V(酸) |
| C.V(酸)=2V(碱) | D.V(碱)=2V(酸) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果 实验数据 实验数据实验序号 | FeSO4溶液体积读数/mL | |
| 滴定前 | 滴定后 | |
| 第一次 | 0.10 | 16.20 |
| 第二次 | 0.30 | 15.31 |
| 第三次 | 0.20 | 15.19 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c1>c2 | B.a1<a2 | C.碱性:甲<乙 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制标准溶液的固体NaOH中混有杂质KOH |
| B.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液的pH等于7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7 |
| C.25℃时, 0.2 mol/L NaOH溶液与0.2 mol/L乙酸溶液恰好中和,所得溶液的pH等于7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com