
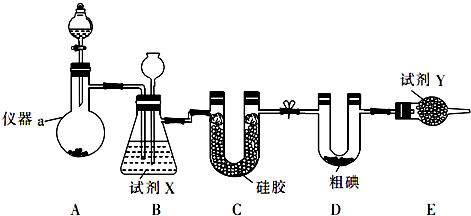
分析 实验室可用如图装置制取ICl3:装置A是Ca(ClO)2)和浓盐酸反应制取氯气,盐酸易挥发,反应制取的氯气中含有氯化氢、水蒸气等杂质,通过装置B中长导管内液面上升或下降调节装置内压强,B为安全瓶,可以防止倒吸,根据B中内外液面高低变化,可以判断是否发生堵塞,同时利用饱和食盐水除去氯气中的氯化氢,装置C是利用硅胶吸收水蒸气,装置D碘和氯气反应生成ICl3,氯气有毒需进行尾气处理,E装置吸收多余的氯气,防止污染空气.
(1)盐酸易挥发,反应制取的氯气中含有氯化氢,除去氯化氢用饱和食盐水,氯气有毒需进行尾气处理;
(2)次氯酸钙具有强的氧化性,能够氧化盐酸,生成氯化钙、氯气和水,依据化合价升级数目相同配平方程式;
(3)装置B作安全瓶,监测实验进行时C中是否发生堵塞,C发生堵塞时,B中压强增大,吸滤瓶中液面下降,长颈漏斗中液面上升;
(4)水浴的温度不超过100℃,水浴能简便控制加热的温度,且能使受热容器受热均匀;
(5)以淀粉溶液为指示剂,用2.0mol/L的Na2S2O3标准液进行滴定,终点现象为当加入最后一滴标准液时,溶液由蓝色变为无色且半分钟内不恢复蓝色;根据化学反应可得关系式:ICl3~2I2~4S2O32-,令样品中ICl3的物质的量x,根据关系式计算.
解答 解:(1)装置A是Ca(ClO)2)和浓盐酸反应制取氯气,盐酸易挥发,反应制取的氯气中含有氯化氢、水蒸气等杂质,氯气在饱和食盐水中溶解度不大,用B装置可以除去氯气中的氯化氢气体;所以试剂X为饱和食盐水,反应后剩余的氯气能够污染空气,不能排放到空气中,装置E为球形干燥管,装有固体药品碱石灰,吸收多余的氯气,防止污染空气,
故答案为:饱和食盐水、碱石灰;吸收多余的氯气,防止污染空气;
(2)漂白粉固体和浓盐酸反应生成氯化钙、氯气和水,化学方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
(3)装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,吸滤瓶中液面下降,长颈漏斗中液面上升,
故答案为:吸滤瓶中液面下降,长颈漏斗中液面上升;
(4)因水浴能简便控制加热的温度,且能使受热反应试管受热均匀,由于氯气与单质碘需在温度稍低于70℃下反应,应采取水浴加热,
故答案为:水浴加热;
(5)ICl3+3KI═2I2+3KCl,碘与淀粉作用显蓝色,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32-═2I-+S4O62-),终点现象为当加入最后一滴标准液时,溶液由蓝色变为无色且半分钟内不恢复蓝色,令样品中ICl3的物质的量x,则根据化学反应可得关系式:
ICl3~2I2~4S2O32-,
1 4
x 2 mol•L-1×20×10-3L
解得:x=1×10-2mol,
该样品中ICl3的质量分数为$\frac{0.01mol×233.5g/mol×\frac{100mL}{25mL}}{10.0g}$=93.4%,
故答案为:当加入最后一滴标准液时,溶液由蓝色变为无色且半分钟内不恢复蓝色;93.4%.
点评 本题考查物质的制备实验及含量测定,为高频考点,把握实验原理、装置的作用、化学反应中的物质的量关系为解答的关键,侧重分析、实验及计算能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
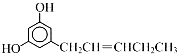
| A. | 既有σ键又有π键 | |
| B. | O-H键的极性强于C-H键的极性 | |
| C. | 是极性分子 | |
| D. | 该物质的分子之间不能形成氢键,但它可以与水分子形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 | |
| C. | 500℃左右比在室温时更有利于提高合成氨的转化率 | |
| D. | 对2HI?H2+I2平衡体系增加压强使颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 LCl2分别与铁和铜反应时,失电子数目均为NA | |
| B. | 1mol Na2O2与CO2足量反应时,转移NA个电子 | |
| C. | 12.0gNaHSO4固体中含有的阳离子数目为0.2NA | |
| D. | 1mol Na2O2晶体中含有的阴离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向碳酸氢镁溶液中加过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| C. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOC-COOH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
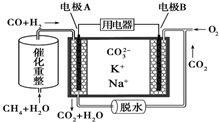
| A. | 放电时负极有CO2生成 | |
| B. | 正极反应为O2+2CO2+4e-═2CO32- | |
| C. | 反应CH4+H2O$→_{△}^{催化剂}$3H2+CO,每消耗1molCH4转移6mol 电子 | |
| D. | 该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闪电时,N2变为NO | B. | NO被空气中O2氧化为NO2 | ||
| C. | 工业上,用N2合成氨 | D. | 豆科植物根瘤菌把N2变成NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com