
【题目】298K时,在20.00 mL 0.1 mol·L-1 C6H5COOH(苯甲酸)溶液中滴加0.1 mol·L-1 NaOH溶液,溶液中离子浓度与pH关系如图所示。下列说法正确的是
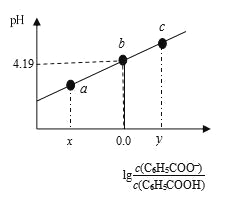
A. a点:溶液中c(Na+)>c(C6H5COO-)>c(H+)>c(OH-)
B. b点:对应的NaOH溶液体积为10 mL
C. 对b点溶液加热(不考虑挥发),实现曲线由b点向c点的变化
D. 298K时,C6H5COOH的电离常数为1×10-4.19
【答案】D
【解析】
A.由题图知,a点溶液呈酸性,根据电荷守恒c(H+)+c(Na+)=c(C6H5COO-)+c(OH-)可知离子浓度大小排序为c(C6H5COO-)>c(Na+)>c(H+)>c(OH-),A错误;
B.加入氢氧化钠溶液的体积为10.00mL时,溶液中的溶质为C6H5COONa、C6H5COOH且二者浓度相等,C6H5COOH的电离方程式为C6H5COOH![]() H++C6H5COO-,由于电离常数与浓度无关,选择b点计算Ka,Ka=c(H+)·c(C6H5COO-)/c(C6H5COOH)≈c(H+)=1×10-4.19,C6H5COOH的电离程度大于C6H5COO-的水解程度,则溶液中c(C6H5COO-)>c(C6H5COOH),而b点溶液中c(C6H5COO-)=c(C6H5COOH),故加入的氢氧化钠溶液体积小于10.00mL,B错误;
H++C6H5COO-,由于电离常数与浓度无关,选择b点计算Ka,Ka=c(H+)·c(C6H5COO-)/c(C6H5COOH)≈c(H+)=1×10-4.19,C6H5COOH的电离程度大于C6H5COO-的水解程度,则溶液中c(C6H5COO-)>c(C6H5COOH),而b点溶液中c(C6H5COO-)=c(C6H5COOH),故加入的氢氧化钠溶液体积小于10.00mL,B错误;
C.b点溶液中存在C6H5COOH、C6H5COONa,对b点溶液加热,,C6H5COOH的电离程度增大,溶液的pH降低,可实现曲线由b点向a点的变化,C错误;
D.根据以上分析可知D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),平衡时,SO3为n mol,相同温度下,分别按下列配比在相同容积的密闭容器中放入起始物质,平衡时,SO3的物质的量大于n mol的是( )
2SO3(g),平衡时,SO3为n mol,相同温度下,分别按下列配比在相同容积的密闭容器中放入起始物质,平衡时,SO3的物质的量大于n mol的是( )
A. 2 mol SO2和1 mol O2B. 4 mol SO2和1 mol O2
C. 2 mol SO2、1 mol O2和2 mol SO3D. 2 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
B. 用惰性电极电解AlCl3溶液产生白色沉淀:2Al3++6Cl-+6H2O![]() Al(OH)3↓+3H2↑+3Cl2↑
Al(OH)3↓+3H2↑+3Cl2↑
C. 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+2H2O=4Cr(OH)3↓+3CH3COO-+OH-
D. 用足量的氨水处理硫酸工业的尾气:SO2+NH3·H2O=NH4++HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组利用下图装置制取乙酸乙酯,其中A盛浓硫酸,B盛乙醇、无水醋酸,D盛饱和碳酸钠溶液。
已知:
①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②几种有机物沸点:乙醚34.7℃,乙醇78.5℃,乙酸117.9℃,乙酸乙酯77.1℃;
③乙酸与乙醇反应生成酯的过程中酸分子断裂C-O键,醇分子断裂O—H键。

请回答:
(1)乙醇分子中官能团的名称是__________________。
(2)A的名称是_____________;浓硫酸的主要作用是作____________________。
(3)在B中加入几块碎瓷片的目的是_______;C除起冷凝作用外,另一重要作用是_____。
(4)若参加反应的乙醇为CH3CH2l8OH,请写出用该乙醇制乙酸乙酯的化学方程式__________;该反应类型为___________。
(5)D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,其净化过程如下:
ⅰ:加入无水氯化钙,去除_________________;
ⅱ:最好加入________(填字母序号)作吸水剂;
A 碱石灰 B 氢氧化钾 C 无水硫酸钠
ⅲ:蒸馏,收集77℃左右的馏分,得到较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,①~分别代表12种元素,请回答:
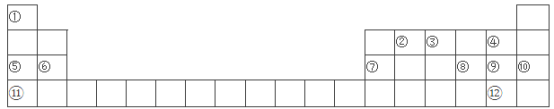
(1)写出12种元素中化学性质最不活泼的元素的原子结构示意图______________。
(2)在元素周期表中的位置是____________________________。
(3)12种元素形成的单质中硬度最大的是________________ (填名称)。
(4)用电子式表示①与形成化合物的过程_______________________。
(5)可以用来验证⑥⑦两种元素金属性强弱的实验是__________(填字母序号)。
a 将在空气中放置已久的这两种元素的块状单质分别放入水中
b 将形状、大小相同的无氧化膜的这两种元素的单质分别和同浓度同体积的盐酸反应
c 将形状、大小相同的无氧化膜的这两种元素的单质分别和温度相同的热水作用,并滴入酚酞
d 比较这两种元素的氢化物的热稳定性
(6)⑧⑨两种元素的简单阴离子中还原性较强的是________(填离子名称);用一个置换反应证明这一结论__________________________(写化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3[Fe(CN)6]及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b所示)发生了变化。已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)。则下列说法错误的是
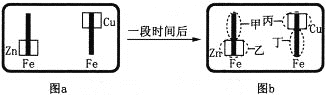
A. 甲区发生的电极反应式:Fe-2e-=Fe2+ B. 乙区产生Zn2+
C. 丙区呈现红色 D. 丁区呈现蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,甲、乙两个容积相等且不变的密闭容器中分别加入1molNH2COONH4 和2 molNH2COONH4, 均发生反应 NH2COONH4(s)![]() 2NH3(g)+CO2(g)。 当两容器中反应均达到平衡时, 下列说法不正确的是
2NH3(g)+CO2(g)。 当两容器中反应均达到平衡时, 下列说法不正确的是
A. NH2COONH4 的平衡转化率相等 B. NH3 的体积分数相等
C. 气体的平均相对分子质量相等 D. 平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学规范保存试剂以防变质,下列试剂在实验室中的保存方法错误的是( )
A.少量金属钠保存在盛有煤油的广口瓶中
B.浓硫酸盛放在使用橡胶塞密封的广口瓶中
C.浓硝酸密封盛放在棕色细口玻璃瓶中,置于阴凉处
D.保存FeSO4溶液加入少量铁粉并密封
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2===I2+2H2O
B. 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
D. 用铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com