
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式为____________。
(2)装置A中的烧瓶内固体可选用_________(填字母)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
B_________,D__________,E_________。
(4)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出该反应的化学方程式:__________________;该反应中每消耗标准状况下8.96LNH3转移电子_________mol.
【答案】
(1)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)AB(3)I、II、III
(4)4NH3+6NO==5N2+6H2O、1.2mol
【解析】
试题分析:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,离子反应为MnO2+4H++2C1-![]() Mn2++C12↑+2H2O,故答案为:MnO2+4H++2C1-
Mn2++C12↑+2H2O,故答案为:MnO2+4H++2C1-![]() Mn2++C12↑+2H2O;
Mn2++C12↑+2H2O;
(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、B.生石灰是碱性物质,且溶解于水时放出热量,C、二氧化硅不溶于水,D.五氧化二磷虽然溶于水时放热,但是酸性物质,故选AB,故答案为:AB;
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ,故答案为:Ⅰ;Ⅱ;Ⅲ;
(4)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质氮气和水,反应的化学方程式为4NH3+6NO==5N2+6H2O,标准状况下8.96LNH3的物质的量为![]() =0.4mol,转移电子的物质的量为
=0.4mol,转移电子的物质的量为![]() ×4×3mol=1.2mol,故答案为:4NH3+6NO==5N2+6H2O、1.2mol。
×4×3mol=1.2mol,故答案为:4NH3+6NO==5N2+6H2O、1.2mol。


科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电时的化学方程式为:2K2S2 +KI3 = K2S4 +3KI。装置(Ⅱ)为电解含有0.5mol NaCl的溶液示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是
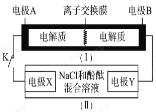
A.K+从右到左通过离子交换膜
B.电极A上发生的反应为:3I-﹣2e-= I3-
C.电极X上发生的反应为:2Cl-﹣2e-= Cl2↑
D.当有0.1 mol K+通过离子交换膜,X电极上产生1.12 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,用石墨电极电解2.0 L 0.5 mol·L-1CuSO4溶液。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
(1)发生氧化反应的是 极,电极反应式为 。
(2)若电解后溶液的体积不变,则电解后溶液的H+浓度为 。
(3)若将溶液恢复到与电解前一样,则需加入 mol的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
①1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA
②过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
③密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
④235g核素![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子(
,净产生的中子(![]() )数为10NA
)数为10NA
⑤氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
⑥铜粉溶于1L0.5mol/L稀硝酸中,当生成标况下2.24LNO时,溶液中的氮原子数为0.4NA个
⑦标准状况下,11.2升氯气溶于水,转移电子数为0.5 NA
⑧12g石墨和C60的混合物中质子总数一定为6NA
⑨25℃时,1L molL-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子
A.②⑥⑧ B.①②⑥ C.③⑦⑧ D.①⑤⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.纯水导电性很差,所以水不是电解质
B.判断某化合物是否为电解质,应看其在一定条件下能否电离
C.酸、碱和盐类都属于电解质,其他化合物都不是电解质
D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关HF和HC1判断正确的是
A. 键长:HF>HCl B. 键能:HF>HC1
C. 稳定性:HCl>HF D. 共用电子对偏移程度:HCl>HF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是常见的氧化钠,某化学小组的同学欲通过以下实验确定炭粉与Na2O2的反应产物。
【实验步骤】
Ⅰ.按如图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。

Ⅱ.将0.6g炭粉与3.9gNa2O2均匀混合,装入A装置中的反应容器,在靠近试管口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸CO变黑,可用于检验是否有CO生成)。
Ⅲ.用酒精灯微微加热A装置中的反应容器
【实验现象】
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
回答下列问题:
(1)在A装置中方框内的仪器可以选用_____________(①②③④⑤中选出所需的装置,使仪器装置图完整)。

(2)装置B的作用是________________。
(3)通过探究发现,装置A中只发生反应2Na2O2+C![]() Na2CO3+X,则X为___________(填化学式)。
Na2CO3+X,则X为___________(填化学式)。
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种新物质.已知反应过程中转移6.02×1023个电子时,生成53g Pd,该反应的化学方程式为________________________。
(5)将装置A中完全反应后所得物质溶于适量水,配成溶液,回答下列问题:
①所得溶液的溶质是___________(填化学式)。
②常温,若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为___________。
(6)写出Na2O2的一种重要用途_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中常加入亚疏酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。
![]()
下列说法不正确的是
A. 若试剂A选择氯水,则试剂B可选择NaOH标准液
B. 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C. 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
D. 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com