
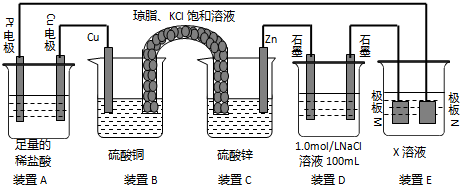
分析 (1)B和C装置形成原电池,锌作负极,铜作正极,正极上铜离子得电子生成铜,盐桥中的K+、Cl-的移动方向为K+移向正极,Cl-移向负极;
(2)A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电;
(3)电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同;若装置E电解精炼铜,则阳极N的材料为粗铜板发生氧化反应;
(4)根据转移电子守恒计算生成气体的体积.
解答 解:(1)B和C装置形成原电池,锌作负极,铜作正极,正极上铜离子得电子生成铜,电极反应式为:Cu 2++2e-=Cu,盐桥中的K+、Cl-的移动方向为K+移向左侧正极,Cl-移向右侧负极,故答案为:Cu 2++2e-=Cu;A;
(2)A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电,装置A中总反应的离子方程式为Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑,
故答案为:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑;
(3)镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同,若装置D的目的是在某镀件上镀银,则X为硝酸银溶液,N作阳极,应该是银,若装置E电解精炼铜,则阳极N的材料为粗铜板发生氧化反应,反应式为 Zn-2e-═Zn2+,Cu-2e-═Cu 2+,
故答案为:AgNO3; Ag;N; Zn-2e-═Zn2+ Cu-2e-═Cu 2+;
(4)当装置A中Cu电极质量改变6.4g时,n(Cu)=0.1mol,则转移0.2mol电子,装置D中n(NaCl)=0.1mol,
阳极首先发生2Cl-2e-=Cl2↑、其次发生4OH-4e-=2H2O+O2↑,则阳极首先生成0.05molCl2,其次生成0.025molO2,
阴极只发生2H++2e-=H2↑,生成0.1molH2,则总共生成0.175mol气体,体积为0.175mol×22.4L/mol=3.92L,
故答案为:3.92.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子放电顺序是解本题关键,难点是电极反应式的书写,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O | |
| C. | 2H2+O2═2H2O | |
| D. | CaCO3═CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物与浓溴水可发生取代反应 | |
| B. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 该有机物能与Na、Na2CO3、NaHCO3溶液发生反应 | |
| D. | 该有机物经催化氧化后与银氨溶液水浴加热,可生成光亮的银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定不可以自发进行 | |
| B. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| C. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.1molN5+离子中所含的电子数为3.4NA | |
| C. | 5.6g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 用溶有1molFeCl3的饱和溶液制Fe(OH)3胶体,制成的胶体中含有的胶粒数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,0.1NA个HCl分子的体积为22.4L | |
| B. | 标准状况下,22.4L氖气含有2NA个原子 | |
| C. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-离子数目为0.6NA | |
| D. | 1mol氖气中含有的电子数目为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com