
| A. | 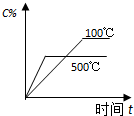 | B. | 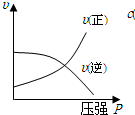 | C. | 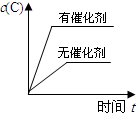 | D. |  |
分析 A、△H<0,升高温度,平衡逆向移动;
B、压强增大时正逆反应速率都增大;
C、催化剂不影响平衡移动;
D、温度相同压强增大时平衡向气体体积减小的正向移动;等压时温度降低时,平衡向放热方向移动.
解答 解:A、500℃>100℃,温度升高时平衡向吸热的逆向移动,则生成物C的百分含量应该减小,故A正确;
B、压强增大时正逆反应速率都增大,故B错误;
C、催化剂不影响平衡移动,有无催化剂c(C)相同,故C错误;
D、压强增大时平衡向气体体积减小的正向移动,反应物A的转化率增大,作一等压线,温度降低时,平衡正向移动,反应物A的转化率也增大,故D正确;
故选AD.
点评 本题考查了平衡移动的图象问题,注意先拐先平数值大的原则,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量的递增而引起的变化 | |
| B. | 元素的化合价呈周期性的变化 | |
| C. | 元素原子核外电子排布呈周期性的变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. ②NaOH
②NaOH ③NH3
③NH3 ④N2
④N2
 ③NH3
③NH3 ④H2SH-S-H.
④H2SH-S-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 供电时的总反应为2H2+O2=2H2O | |
| B. | 负极电极反应为2H2+4OH--4e-=4H2O | |
| C. | 正极电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中A的金属性最强 | |
| B. | 原子半径A>B,离子半径A+>C2- | |
| C. | 同族元素中C的氢化物稳定性最高 | |
| D. | 同周期元素中B的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Fe)<n(S),总质量等于44 g | B. | n(Fe)>n(S),总质量小于44 g | ||
| C. | n(Fe)=n(S),总质量大于44 g | D. | n(Fe)>n(S),总质量等于44 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com