
科目:高中化学 来源: 题型:

| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
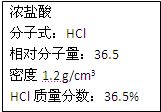 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A.2∶3 B.4∶3 C.10∶3 D.11∶3
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省高三第一次月考化学试卷(解析版) 题型:选择题
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为1∶3,则此反应中被还原的氯元素与被氧化的氯元素原子的物质的量之比是
A.1∶4 B.11∶3 C.3∶1 D.4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com