
常温下,1 mol 化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是 ( )。
| 共价键 | H—H | F—F | H—F | H—Cl | H—I |
| E(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
A.432 kJ·mol -1>E (H-Br)> 298 kJ·mol-1
B.表中最稳定的共价键是 H—F键
C.H2(g)―→2H (g) ΔH= + 436 kJ·mol-1
D.H2 (g)+F2===2HF(g) ΔH=-25 kJ·mol-1
科目:高中化学 来源: 题型:
下列有关实验的叙述中,不正确的有( )
①乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开 ②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现 ③向蛋白质溶液中加入饱和(NH4)2SO4溶液,出现盐析现象,加水溶解 ④溴乙烷与NaOH的水溶液混合共热可得到乙烯; ⑤用盐析法分离高级脂肪酸钠和甘油的混合溶液 ⑥用渗析法除去蛋白质中混有的少量Na+和Cl-
A.①③ B.②④
C.④⑥ D.②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,反应速率(v)与温度(T)、SO2的体积分数[V(SO2)%]与压强(p)的关系分别如图甲、图乙所示。下列说法不正确的是 ( )。

A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点表示温度为T0时,反应已经达到平衡
C.图乙中,温度恒定时,a、b两点对应的反应速率:va>vb
D.图乙中,温度恒定时,c点的反应正在向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应的本质是旧化学键的断裂和新化学键的形成。已知某些化学键的键能数据如下:
| 化学键 | H—H | Cl—Cl | H—Cl |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
则下列热化学方程式不正确的是 ( )。
A.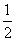 H2(g)+
H2(g)+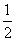 Cl2(g)===HCl (g)
Cl2(g)===HCl (g)
ΔH=-91.5 kJ· mol -1
B.H2 (g) +Cl2 (g) ===2HCl (g)
ΔH=-183 kJ· mol-1
C.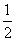 H2(g)+
H2(g)+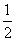 Cl2(g)===HCl (g)
Cl2(g)===HCl (g)
ΔH=+91.5 kJ· mol -1
D.2HCl (g) ===H2 (g)+Cl2 (g)
ΔH=+183 kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学发现在炽热的煤炭上洒少量水,煤炉中会产生淡蓝色的火焰,炉火更旺。因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧时放出更多的热量”。已知:煤炭的燃烧热为 393.15 kJ · mol-1 ,氢气的燃烧热为 242 kJ· mol-1 ,一氧化碳的燃烧热为 283 kJ · mol-1 。下列有关说法正确的是
A.表示氢气燃烧热的热化学方程式为 2H2(g)+ O2(g)===2H2O (l) ΔH= -242 kJ · mol-1
B.表示CO 燃烧热的热化学方程式为 2CO(g)+ O2(g)===2CO2 (g) ΔH= - 566 kJ · mol-1
C.“炉火更旺”是因为少量的固体煤炭转化为可燃性气体
D.因 242 kJ·mol-1 +283 kJ· mol-1 >393.15 kJ·mol-1 ,故该同学的结论是对的
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电池的说法不正确的是 ( )。
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
有关电化学知识的描述正确的是 ( )。
A.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是铁作负极,铜作正极,其负极反应式为Fe-2e-===Fe2+
D.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+
2OH-===Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
1)[2014·四川,11(4)(5)]①MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是________________________________________________________________
_______________________________________________________________。
②MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是_________________________________________________________。
(2)[(2014·江苏,20(1)]硫化氢的转化是资源利用和环境保护的重要研究课题。
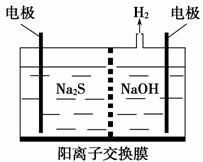
由硫化氢获得硫单质有多种方法。 将烧碱吸收H2S后的溶液加入到如上图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S
(n-1)S+S2-===S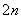
①写出电解时阴极的电极反应式:___________________________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成________________________________________________________________。
(3)[2014·重庆,11(4)]一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
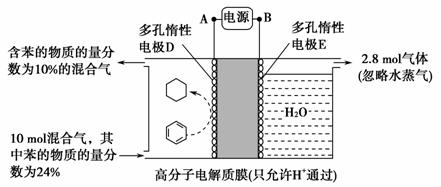
①导线中电子移动方向为________。 (用A、D表示)
②生成目标产物的电极反应式为________。
③该储氢装置的电流效率η=________(η=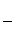 ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com