
【题目】根据表中短周期元素性质的数据判断,下列说法一定错误的是

A. ④是周期表中非金属性最强的元素
B. ①是周期表中原子半径最小的元素
C. ②④⑤在位于同一个周期
D. ①③两元素组成的化合物分子与③④两元素组成的化合物分子空间构型相同
【答案】A
【解析】试题分析:短周期元素中,元素最高化合价与其族序数相等,最低化合价=族序数-8,同一主族的元素,原子半径随着原子序数的增大而增大,同一周期元素中,原子半径随着原子序数的增大而减小。①化合价是+1价,结合原子半径可知该元素是H元素;②有-3、+5价,结合原子半径可知该元素是P元素;③有-4、+4价,结合原子半径可知该元素是Si元素;④有-1价,结合原子半径可知该元素是Cl元素;⑤化合价是+1价,结合原子半径可知是Na元素。A.④是F元素,根据元素周期律可知F元素是周期表中非金属性最强的元素,错误;B.①是H元素,根据原子半径大小变化规律可知H元素周期表中原子半径最小的元素,正确;C.②④⑤分别是P、Si、Na元素,都是第三周期的元素,正确;D.①③两元素组成的化合物分子是SiH4是正四面体结构;③④两元素组成的化合物分子SiCl4也是正四面体结构,所以二者的空间构型相同,正确。


科目:高中化学 来源: 题型:
【题目】(1) 如图所示为二维平面晶体示意图,所表示的化学式为AX3的是________。

(2) 下图为一个金属铜的晶胞,请完成以下各题。

① 该晶胞“实际”拥有的铜原子数是________个。
② 该晶胞称为________(填序号)。
A.六方晶胞 B.体心立方晶胞
C.面心立方晶胞 D.简单立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64 g·mol-1,金属铜的密度为ρ g·cm-3,则阿伏加德罗常数为________(用a、ρ表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。

1、测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH="2" MnO(OH)2↓
酸性条件下,MnO(OH)2将I氧化为I2:②MnO(OH)2+I+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2:③2S2O32+I2=S4O62+2I
2、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mLMnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填“是”或“否”)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成治疗高血压药物奈必洛尔的重要中间体,其部分合成路线图如下(Ph代表苯基):
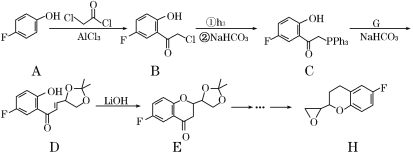
(1)化合物C的含氧官能团名称为________、________。
(2)B→C的反应类型是________。
(3)写出A→B的化学反应方程式________。
(4)C→D的转化中,反应物G的分子式为C6H10O3,生成物除D外还有Ph3P=O,则G的结构简式为_________
(5)写出同时满足下列条件的B的一种同分异构体的结构简式________。
Ⅰ.分子中含有一个酯基和一个手性碳原子,有4种化学环境不同的氢;
Ⅱ.不能发生银镜反应;
Ⅲ.能发生水解反应,且其中一种水解产物能与FeCl3溶液发生显色反应。
(6)已知:
①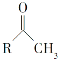
![]() RCOONa
RCOONa
②![]()
![]()
![]()
化合物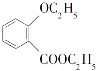 是一种重要的有机合成中间体,请写出以苯酚、乙醇和
是一种重要的有机合成中间体,请写出以苯酚、乙醇和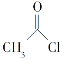 为原料制备该化合物的合成路线流程图(无机试剂作用)。合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂作用)。合成路线流程图示例如下:
H2C===CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 山梨酸是一种常用的食品防腐剂,以下是山梨酸(J)的一种工业合成途径:

已知:(1)A是衡量一个国家石油化工发展水平的重要标志。
(2)![]()
(3)![]()
(4)![]()
回答下列问题:
(1)E的结构简式为 ,含有官能团的名称为 。
(2)G和H在一定条件下合成I的化学方程式为 ,反应类型为 。
(3)写出满足下列条件的山梨酸的所有同分异构体 。①分子中有五元碳环;②核磁共振氢谱有四个峰;③分子中有—COO—结构
(4)下列说法正确的是 。
A.I可以发生加成、取代、氧化、消去反应
B.I可以和新制的氢氧化铜反应
C.1molI完全燃烧可以消耗7molO2
D.J和等物质的量的H2加成有两种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳单质及其化合物有广泛的应用。
(1)碳的同素异性体金刚石、石墨和C60晶体中,能溶于有机溶剂的是___,原因是_______。
(2)CH3COCH=CHCH3分子中,C原子所采取的杂化类型有____________。
(3)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用虚线标出了石墨的一个六方晶胞。该晶胞中含有的碳原子数为_____个。
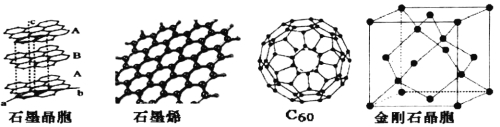
(4)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,如图所示。1mol石墨烯中含有的六元环个数为______,下列有关石墨烯说法正确的是________
a.晶体中碳原子间全部是碳碳单键
b.石墨烯中所有碳原子可以处于同一个平面
c.从石墨中剥离得到石墨烯需克服分子间作用力
(5)石墨烯可转化为C60,C60的结构如图所示,该分子是由五边形和六边形构成的球体,其中五边形有12个,六边形有________个。
(6)金刚石晶胞如图所示,则金刚石晶胞中原子的配位数为_____,原子空间利用率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为_______。
②LiBH4由Li+和BH4-构成,BH4-的立体结构是_________,B原子的杂化轨道类型是________。
Li、B、H元素的电负性由大到小排列顺序为________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径Li+_______H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:

M是________ (填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为________,NaH的理论密度是___________g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”。凡具有一个手性碳原子的化合物一定具有光学活性。例如,有机物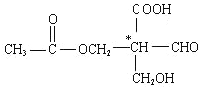 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
A、与NaOH溶液共热 B、与银氨溶液共热
C、与金属钠反应 D、与氢气发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com