
| A. | 以铜作阴极、铁作阳极、硫酸铜为电解液可完成铁上镀铜 | |
| B. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| C. | 由反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,可得出C的非金属性强于Si | |
| D. | pH=9的醋酸钠溶液和pH=9的氨水中水的电离程度相同 |
分析 A、电镀时,镀件作阴极,镀层金属是阳极,电镀液中必须含有镀层金属阳离子的盐;
B、水的电离过程是吸热过程,升高温度,平衡向右移动;
C、元素的非金属性是指元素的原子得电子的能力,得电子能力越强对应单质的氧化性越强;
D、含有弱根离子的盐能促进水的电离,酸或碱能抑制水的电离,据此解答即可.
解答 解:A、电镀时,镀件作阴极,镀层金属是阳极,电镀液中必须含有镀层金属阳离子的盐,即铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜,故A错误;
B、水的电离过程是吸热过程,升高温度,平衡向右移动,水的离子积增大,氢离子浓度增大,所以pH减小,故B正确;
C、该反应中C是还原剂,Si是还原产物,主要体现碳的还原性,故C错误;
D、pH=9的醋酸钠溶液氢氧根离子来源于水的电离,即水电离出的氢氧根离子浓度为$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5,pH=9的氨水氢离子来源于水的电离,即水电离出的氢离子浓度为10-9,故两者不相同,故D错误;
故选B.
点评 本题主要考查的是水的电离以及水的电离影响因素,含有弱根的盐促进水的电离,酸和碱均能抑制水的电离,据此解答即可.


科目:高中化学 来源: 题型:选择题
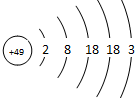 张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In在反应中容易失电子 | |
| B. | In为长周期元素 | |
| C. | In的最高价氧化物对应的水化物为强碱 | |
| D. | In为过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电极a是负极 | |
| B. | 电极b上的电极反应为O2+2H2O+4e-=4OH- | |
| C. | 外电路中电子由电极b流向电极a | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的下列说法中正确的是( )
的下列说法中正确的是( )| A. | 分子式为C9H9O2 | |
| B. | 含有三种官能团 | |
| C. | 可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 | |
| D. | 可以发生取代反应和加成反应,但不能发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
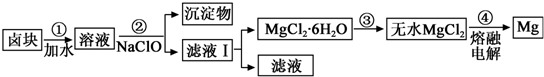
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质Cl2、Br2、I2的氧化性 | |
| B. | 气态氢化物NH3、H2O、HF的稳定性 | |
| C. | 碱金属单质Li、Na、K与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | Li、Na、K的电子层数依次增多 | |
| D. | N、O、F得电子能力依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>Y>X>W | D. | Z>X>Y>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | W | ||
| X | Z | Q |
| A. | X的氧化物是红宝石、蓝宝石的主要成分 | |
| B. | Q的最高价氧化物的水化物的浓溶液中只存在一种分子 | |
| C. | W的氧化物有多种,其中只有+2价的氧化物有毒,对人体有危害 | |
| D. | Z的单质可由Z的氧化物与Y的单质反应制得,说明单质Y还原性强于单质Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com