
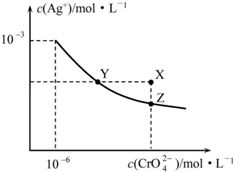
| A. | 在t℃时,Ag2CrO4的Ksp=1×10-9 | |
| B. | X点有Ag2CrO4沉淀生成 | |
| C. | 通过加热蒸发可以使溶液由Y点变到Z点 | |
| D. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点变到X点最终变到Z点 |
分析 A.Ksp=c2(Ag+)c(CrO42-);
B.由图可知,X在Z的上方,有沉淀生成;
C.Y点变到Z点,Ag+浓度减小,CrO42-离子浓度增大;
D.在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上.
解答 解:A.曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为Ag2CrO4(s)?2Ag+CrO42-,则Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故A错误;
B.Z为溶解平衡点,由图可知,X在Z的上方,则X点有Ag2CrO4沉淀生成,故B正确;
C.Y点变到Z点,Ag+浓度减小,CrO42-离子浓度增大,而蒸发时(Ag+)、c(CrO42-)均增大,与图象不符,故C错误;
D.在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡及图象,为高频考点,把握Ksp的计算、图象中溶解平衡点为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
| 混合液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA | |
| B. | 常温下,1L0.1mol•L-1CuSO4溶液中粒子总数小于0.2NA | |
| C. | 1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”是指从泔水中提取的油脂,它也是一种资源,但不能食用,可用于生产燃料油或用于制肥皂 | |
| B. | 媒体曝光的制造问题胶囊的工业明胶的主要成分是蛋白质 | |
| C. | 塑化剂DEHP是邻苯二甲酸(2─乙基己基)二酯,对人体无害可用作食品添加剂 | |
| D. | PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再用半透膜渗析的方法分离PM2.5微粒与可溶性吸附物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子排布式为:1s22s22p63s23p63d34s2 | |
| B. | 该元素为VB | |
| C. | 元素为ⅢB族元素 | |
| D. | 该元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4,H2O2,NH3 | B. | H2O,CO2,Na2O2 | C. | Na2O,NaCl,MgCl2 | D. | NaOH,NaClO,Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
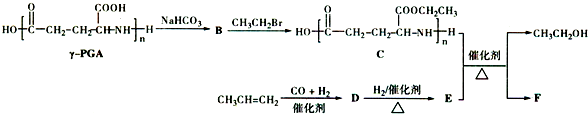
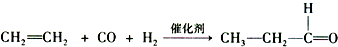
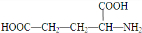 .
.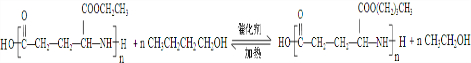 .
.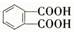 )反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式
)反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式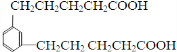 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 现象 |
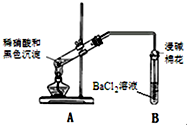 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
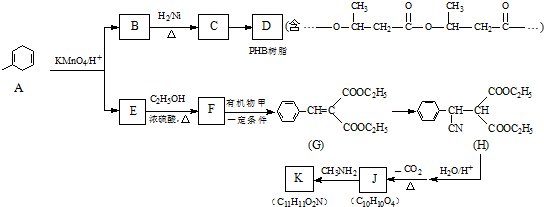
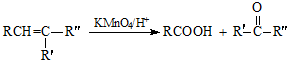
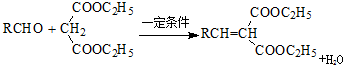
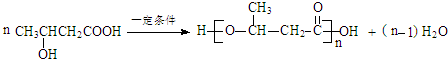 :.
:. .
.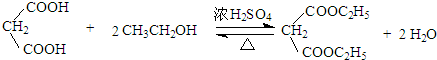 .
.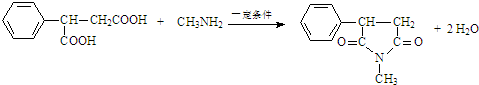 .
.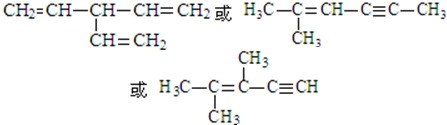 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com