
| 序号 | 加入的稀硫酸浓度 | 反应时间/min | 收集的气体/mL | 反应速率mL•min-1 |
| ① | 1mol•L-1 | 11 | 10 | |
| ② | 2mol•L-1 | a | 10 | b |
| ③ | 4mol•L-1 | 10 | 5.0 |
分析 实验设计:本实验是采取控制变量的方法根据金属锌、铝、铁分别与稀盐酸反应的相对速率来探究金属锌、铝、铁的金属活动性,而反应速率受温度、浓度、催化剂、表面积、压强等内外因的影响,而金属活动性是内因,因此要控制外界条件相同,如反应体系的温度相同;盐酸的浓度相同;盐酸的体积相同;金属的表面积相同;
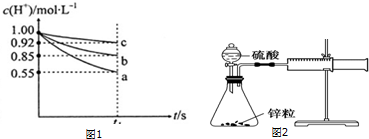
实验探究:(1)由图知c(H+)浓度变化最小的是c,即反应速率最慢,金属性最弱;
(2)由图知c(H+)浓度变化最小的是c,即反应速率最慢,金属性最弱,abc对应的金属分别为铝锌铁,再结合图1分析Ⅰ、Ⅱ、Ⅲ;
Ⅳ:根据①③中数据计算出①的反应速率、③的反应时间;再根据浓度对反应速率的影响判断②可能的时间,结合②的气体体积计算出其反应速率即可.
解答 解:实验设计:本实验是采取控制变量的方法根据金属锌、铝、铁分别与稀盐酸反应的相对速率来探究金属锌、铝、铁的金属活动性,而反应速率受温度、浓度、催化剂、表面积、压强等内外因的影响,而金属活动性是内因,因此要控制外界条件相同,如反应体系的温度相同,盐酸的浓度相同,盐酸的体积相同,金属的表面积相同,
故答案为:反应体系的温度(相同);盐酸的浓度(相同);取用盐酸的体积(相同);金属的(比)表面积(或金属粉末的粗细程度)(相同);
实验探究:(1)由图知c(H+)浓度变化最小的是c,即反应速率最慢,金属性最弱,
故答案为:c;
(2)由图知c(H+)浓度变化最小的是c,即反应速率最慢,金属性最弱,abc对应的金属分别为铝锌铁,结合图1氢离子浓度的变化分析,
Ⅰ:以溶液中c(H+)减少来表示不同反应的速率,v(Al)和v(Zn)的比值为$\frac{0.45mol•{L}^{-1}}{0.15mol•{L}^{-1}}$=3:1,
故答案为:3:1;
Ⅱ:根据反应关系:2Al~6H+,消耗的铝质量m(Al)=$\frac{27g•mo{l}^{-1}×0.45mol•{L}^{-1}×50×1{0}^{-3}L}{3}$,
Zn~2H+,m(Zn)=$\frac{65g•mo{l}^{-1}0.15mol•{L}^{-1}×1{0}^{-3}L}{2}$,所以m(Al)/(Zn)=54:65,
故答案为:54:65;
Ⅲ:铝锌的物质的量减少分别为$\frac{0.45mol•{L}^{-1}×50×1{0}^{-3}L}{3}$、$\frac{0.15mol•{L}^{-1}×50×1{0}^{-3}L}{2}$,二者之比为2:1,
故答案为:2:1;
Ⅳ:①的反应速率为:$\frac{10mL}{11min}$≈0.91mL/min,
③的反应时间为:t=$\frac{10mL}{5.0mL•mi{n}^{-1}}$=2min,
②中硫酸的浓度大于①,则②的反应速率大于①,产生相同量的氢气时②消耗的时间小于①,大于③,结合选项可知②的反应时间a=6min,则②的反应速率为:v=$\frac{10mL}{6min}$≈1.67mL/min,故B正确,
故答案为:
| 序号 | 加入的稀硫酸浓度 | 反应时间/min | 收集的气体/mL | 反应速率mL•min-1 |
| ① | 0.91 | |||
| ② | ||||
| ③ | 2 |
点评 本题探究了温度、浓度等因素对反应速率的影响,题目难度中等,注意掌握影响化学反应速率的因素,试题侧重考查学生的分析、理解能力及化学实验能力,(Ⅳ)为易错点,明确②的反应时间为解答关键.


科目:高中化学 来源: 题型:选择题
| A. | 石墨的能量比金刚石低 | B. | 石墨和金刚石都是碳的同位素 | ||
| C. | 金刚石转变为石墨是物理变化 | D. | 金刚石比石墨更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为: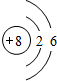 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
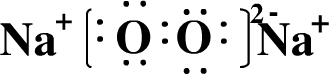 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com