
 ,下列Ⅰ、Ⅱ、Ⅲ反应的类型正确的是( )
,下列Ⅰ、Ⅱ、Ⅲ反应的类型正确的是( )| A. | 加成、加成、氧化 | B. | 加成、氧化、氧化 | C. | 加成、取代、氧化 | D. | 取代、取代、加成 |
分析 丙烯中含有碳碳双键和甲基,碳碳双键能和溴的四氯化碳溶液发生加成反应生成溴代烷,能和氯气在500℃条件下发生取代反应生成3-氯-1-丙烯,碳碳双键能被酸性高锰酸钾溶液氧化,据此分析解答.
解答 解:丙烯中含有碳碳双键和甲基,碳碳双键能和溴的四氯化碳溶液发生加成反应生成1,2-二溴丙烷,该反应为加成反应;
甲基能和氯气在500℃条件下发生取代反应生成3-氯-1-丙烯,该反应是取代反应;
碳碳双键不稳定,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该反应为氧化反应,
故选C.
点评 本题考查有机物结构和性质及有机反应类型判断,为高频考点,明确官能团及其性质关系是解本题关键,反应条件不同导致反应产物不同,注意取代反应和加成反应区别,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al最外层电子数依次增多,单核离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应气态氢化物的稳定性依次增强 | |
| C. | 同周期元素的原子半径以第ⅦA族的为最大 | |
| D. | Na、Mg、Al的氢氧化物的碱性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为1.0mol•L-1 | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.018mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
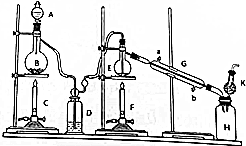
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杂质在溶剂中的溶解度常温时很小,加热时很大 | |
| B. | 在室温时,产品在溶剂中易溶 | |
| C. | 产品在溶剂中的溶解度随温度升高而迅速增大 | |
| D. | 在同一溶剂中,产品比杂质易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(h) 物质的量(mol) | 0 | 2 | 4 | 6 |
| N2 | 1.50 | 1.20 | 1.00 | 1.00 |
| H2 | 4.50 | 3.60 | 3.00 | 3.00 |
| NH3 | 0 | m | 1.00 | 1.00 |
查看答案和解析>>
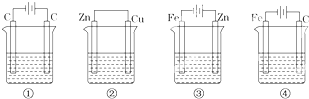
科目:高中化学 来源: 题型:选择题
| A. | 发生氧化反应的为负极 | B. | 正极为电子流入的一极 | ||
| C. | 比较不活泼的金属为负极 | D. | 电流的方向由正极到负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com