
【题目】已知常温下反应①NH3+H+![]() NH
NH![]() (平衡常数为K1),②Ag++Cl-
(平衡常数为K1),②Ag++Cl-![]() AgCl(平衡常数为K2),③Ag++2NH3
AgCl(平衡常数为K2),③Ag++2NH3![]() Ag(NH3)
Ag(NH3)![]() (平衡常数为K3)。
(平衡常数为K3)。
①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是
A.氯化银不溶于氨水
B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀
D.银氨溶液可在酸性条件下稳定存在
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】(1)现有下列各组物质:
①O2和O3 ②CH2=CH﹣CH3和CH2=CH﹣CH=CH2 ③ 和
和
④![]() 和
和![]() ⑤CH3CH2CH3和CH3C(CH3)3
⑤CH3CH2CH3和CH3C(CH3)3
⑥![]() 和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
按要求用序号填空
属于同系物的是________ 属于同分异构体的是_____属于同种物质的是________
(2)下列反应中,属于吸热反应的是__________.
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应.
(3)现有:①干冰 ②金刚石 ③NH4Cl ④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(4)已知:2H2(g)+O2(g)=2H2O(g) △H=-483 kJ·mol -1N2(g)+2O2(g)=2NO2(g) △H=+68kJ·mol -1则H2还原NO2生成水蒸气的热化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图是一套制取并验证氯气部分化学性质的实验装置(装置A制取氯气)。
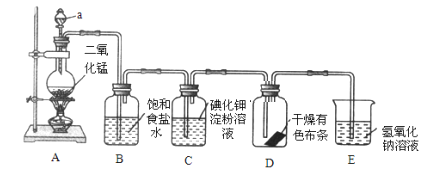
回答下列问题:
(1)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么?__,__。
(2)若要证明干燥的Cl2无漂白性,可在装置D前添加一个装有__的洗气瓶。
(3)装置E的作用是___,该反应的离子方程式为__。
II.欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500mL。
(4)所需浓硫酸的体积为___mL。
(5)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和___。
(6)操作正确的顺序为___(填序号)。
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中贴上标签 E.稀释浓硫酸 F.将溶液转入容量瓶
(7)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.5mol·L-1(填“大于”“小于”或“等于”)。
(8)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH+NH4++HCO3=BaCO3↓+NH3·H2O+H2O
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C.用铁电极电解氯化钠溶液:2Cl+2H2O![]() 2OH+H2↑+Cl2↑
2OH+H2↑+Cl2↑
D.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO+SO2+H2O=CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。有关说法正确的是
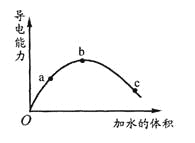
A. a、b、c三点溶液的pH:a>b>c
B. 若使C点的c(CH3COO-)增大,溶液的pH也增大,可加入适量的CH3COONa固体
C. a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D. 用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠保存不当容易变质,某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取10.0g样品,并设计用如图装置来测定过氧化钠的质量分数。
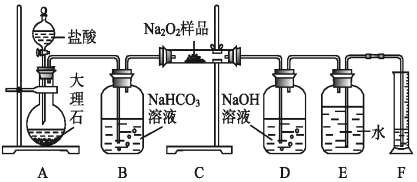
上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出以下装置发生反应的化学方程式:
装置A:___________________________。
装置B:___________________________。
装置C:____________________________。
(2)NaOH溶液的作用是_________________________。
(3)为准确读出氧气的体积需以下操作,正确的顺序为_________。
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
读出量筒内水的体积后,折算成标准状况氧气的体积为1.12L,则样品中过氧化钠的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用![]() 金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
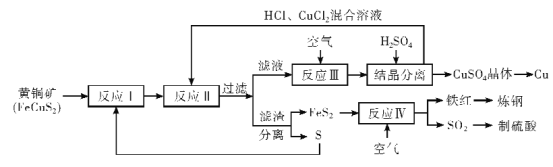
已知:反应II的离子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)FeCuS2中Fe的化合价__________。
(2)写出一条能使反应I充分进行的措施是_______________________________。
(3)反应III的离子方程式为_________________________________。向反应III后的溶液中加入稀硫酸结晶分离的具体操作为 ____________________。
(4)反应IV的化学方程式为____________________________________。反应IV中,也可以氨水吸收尾气SO2再制成化学肥料,写出氨水吸收SO2的化学方程式_________________
(5)该流程中,可循环利用的物质除CuCl2外,还有___________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某粗铜产品中含有Zn、Ag、Au等杂质,如图所示,用CH3OH-碱性燃料电池电解硫酸铜溶液。闭合电键K进行电解。下列说法中不正确的是( )
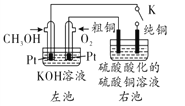
A. 左池负极反应式为CH3OH -6e-+8OH-=CO32-+ 6H2O
B. 通电一段时间后,Ag、Au杂质金属沉积在电解槽底部
C. 若粗铜电极质量减少6.4g,则纯铜电极增重大于6.4g
D. 电解过程中右池纯铜和粗铜分别为阴极和阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com