
下列物质不能通过化合反应得到的是
A.FeCl2 B.Fe(OH)3 C.H2SiO3 D.NaHSO3
科目:高中化学 来源:2014-2015学年陕西省安康市高三上学期第二次教学质量调研化学试卷(解析版) 题型:填空题
(11分)有关短周期元素X、Y、Z、M、N的信息如下:
元素 | 有关信息 |
X | X元素的原子最外层电子数是电子层数的3倍 |
Y | Y元素所在主族序数与所在周期序数之差为4,Y是同周期中原子半径最小的元素 |
Z | Z元素的单质在X元素的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
M | M元素的最高价氧化物对应的水化物能与M元素的最简单气态氢化物反应生成盐R |
N | N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)Z元素在第____ 周期第 族。
(2)Y元素的简单阴离子结构示意图为 ,Y与Z元素的气态氢化物稳定性顺序为____>(写化学式)。
(3)化合物N2X2与CO2反应的化学方程式为 。
(4)盐R中含有的化学键类型有 。盐R的水溶液显酸性,用离子方程式表示其盐溶液显酸性的原因为 。
(5)电解盐NY水溶液的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:填空题
17.⑴(9分)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10 ,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
①请写出方框内物质的化学式: 。
②针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
③若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:计算题
(8分)由Na2CO3·nH2O与NaHCO3组成的混合物28.2 g,放入坩埚中充分加热至质量不变时,将残留固体用足量的盐酸溶解可产生标准状况下的气体3.36 L;若将28.2 g原混合物与盐酸反应,则放出标准状况下气体4.48 L,由此计算。
(1)残留固体质量;
(2)n值;
(3)NaHCO3质量。(写出计算求解的过程)
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入FeCl2溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2
A.①③④⑤ B.①④ C.②③ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
9.2 g金属钠投入到足量的重水(2H216O)中,则产生的气体中含有
A.0.2 mol中子 B.0.4 mol电子
C.0.2 mol质子 D.0.4 mol分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三“一诊”理综化学试卷(解析版) 题型:填空题
(16分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中,NaOH溶液吸收SO2也可生成Na2SO3和NaHSO3的混合溶液
①写出NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时总反应的离子方程式 。
②已知混合液pH随 :n(
:n( )变化关系如下表:
)变化关系如下表:
| 91:9 | 1:1 | 9:91 |
| 8.2 | 7.2 | 6.2 |
当混合液中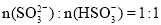 时,c(Na+) c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
时,c(Na+) c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
(2)装置Ⅱ中,酸性条件下,NO被Ce4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO2-的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成的Ce4+从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NO3-,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都郫县高三第二次阶诊断性考试理综化学试卷(解析版) 题型:选择题
能正确表示下列离子方程式的是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32—+H2O
B.铜与浓硫酸混合加热:Cu+2H2SO4(浓)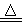 Cu2++SO42—+2H2O+SO2↑
Cu2++SO42—+2H2O+SO2↑
C.过量的浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
D.明矾溶液中滴加氢氧化钡溶液使沉淀质量最大:Al3++2SO SO42—+2Ba2++3OH- = 2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:填空题
(14分)二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
(1)国外学者提出的由CO2制取C的太阳能工艺如图所示
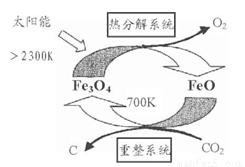
①“热分解系统”发生的反应为2Fe3O4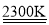 6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为 。
6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为 。
②“重整系统”发生反应的化学方程式为 。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)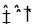 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
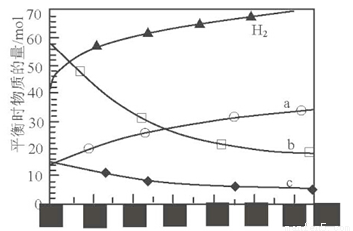
①曲线b表示的物质为 (写化学式)。
②该反应的△H 0(填:“>” 或“<”)
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 (列举l项)。
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示。
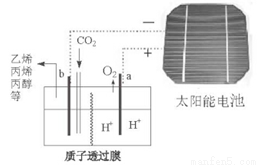
①该工艺中能量转化方式主要有 (写出其中两种形式即可)。
②电解时其中b极上生成乙烯的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com