
【题目】研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是
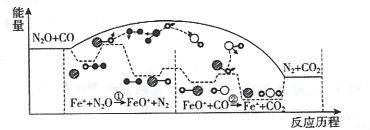
A.反应中Fe+是催化剂,FeO+是中间产物B.总反应速率由反应②的速率决定
C.升高温度,总反应的平衡常数K减小D.当有14g N2生成时,转移1mol e-
【答案】B
【解析】
A.由图可知,Fe+先转化为FeO+,FeO+后续又转化为Fe+,反应前后Fe+未发生变化,因此Fe+是催化剂,FeO+是中间产物,A不符合题意;
B.由图可知,反应①的能垒高于反应②,因此反应①的速率较慢,总反应速率由反应①的速率决定,B符合题意;
C.由图可知,反应物的总能量高于生成物总能量,该反应正向为放热反应,升高温度,平衡逆向移动,总反应的平衡常数K减小,C不符合题意;
D.由图可知,总反应方程式为:N2O+CO![]() CO2+N2,N元素化合价从+1价降低至0价,当有14g N2生成时,即生成0.5molN2,转移电子的物质的量为0.5mol×2=1mol,D不符合题意;
CO2+N2,N元素化合价从+1价降低至0价,当有14g N2生成时,即生成0.5molN2,转移电子的物质的量为0.5mol×2=1mol,D不符合题意;
答案为:B。


科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | 烧瓶中有大量气泡冒出,Na2SiO3溶液变浑浊 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | 非金属性: N>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.0.5 molN4(分子为正四面体结构)含共价键数目为2NA
B.1 L 0.5 mol·L1 Na2S溶液中含阴离子数目小于0.5NA
C.锌与浓硫酸反应生成气体11.2 L(标准状况)时转移电子数目为NA
D.14 g己烯和环己烷的混合物含氢原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
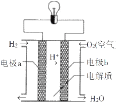
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 | Al、Cu | 稀盐酸 | 偏向Cu |
2 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
回答下列(1)、(2)小题:
⑴实验1中Al作的电极为____(填“正极”或“负极”),Cu作的电极为____(填“正极"或“负极”)。
⑵实验2观察到C(石墨)棒上产生的现象是____,负极的电极反应式为____.如图是电解质为稀硫酸溶液的氢氧燃料电池。该电池的电子从电极____经过导线流向电极____(填a或b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用干燥的H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法不正确的是
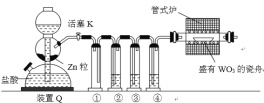
A.①的作用是防倒吸
B.②、③、④中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
C.管式炉中发生反应的化学方程式为:3H2+ WO3![]() W+3H2O
W+3H2O
D.装置Q不能用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16gcm﹣3)配制成1molL﹣1的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为___的容量瓶。
(2)经计算需要___mL浓盐酸,在量取时宜选用下列量筒中的___。
A.5mL B.10mL C.25mL D.50mL
(3)从下列仪器中,不会用到的是___(选序号)。
①量筒 ②玻璃棒 ③药匙 ④容量瓶 ⑤烧杯 ⑥台秤 ⑦胶头滴管 ⑧细口试剂瓶 ⑨标签纸
(4)若实验过程遇到下列情况,对盐酸的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①容量瓶洗涤后仍少许蒸馏水,___;②未经冷却将溶液注入容量瓶中,___;
③摇匀后发现液面下降再加水,___;④定容时俯视观察液面,___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含1个碳原子物质(如CO、CO2、CH4、CH3OH等)为原料的“碳一化学”处于未来化学产业的核心,成为科学家研究的重要课题。请回答下列问题:
(1)已知CO、H2、CH3OH(g)的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-l、-764.5kJ·mol-l。则反应I:CO(g)+2H2(g)=CH3OH(g)△H=___
(2)在温度T时,向体积为2L恒容容器中充入3molCO和H2的混合气体,发生反应I,反应达到平衡时,CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
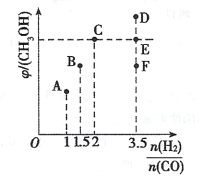
①当起始n(H2)/n(CO)=1时,从反应开始到平衡前,CO的体积分数将___(填“增大”、“减小”或“不变”)。
②当起始n(H2)/n(CO)=2时,反应经过l0min达到平衡,CO转化率为0.5,则0~l0min内平均反应速率v(H2)=___。
③当起始n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的__。(填“D”、“E”或“E”点)。
(3)在一容积可变的密闭容器中充有10molCO和20molH2,发生反应I。CO的平衡转化率(α)与温度(T)、压强(P)的关系如下图所示。
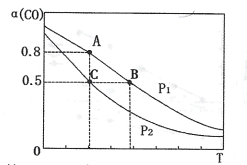
①压强P1=___(填“<”、“=”或“>”)P2;A、B、C三点的平衡常数KA、KB、KC的大小关系为___(用“<”、“=”或“>”表示)。
②若达到平衡状态C时,容器体积为10L,则在平衡状态A时容器体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)==CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)==CO2(g)+H2(g) △H2=-41.2kJ/mol
T1°C时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
请回答下列问题:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=_____
(2)30s时CH4的转化率为_______,20~40s,v(H2)=_______.
(3)T2°C时,该反应的化学平衡常数为1.5,则T2___T1(填“>”“=”或 “<”。)
(4)T1°C时反应③达到平衡的标志为______________。
A.容器内气体密度不变 B.体系压强恒定
C.CO和H2的体积分数相等且保持不变 D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后/span>,其他条件不变,在70 s时再加入2 molCH4和1molCO2,此刻平衡的移动方向为________(填“不移动”“正向”或“逆向"),重新达到平衡后,CO2的总转化率比原平衡____________(填“大”“小”或“相等”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com