
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
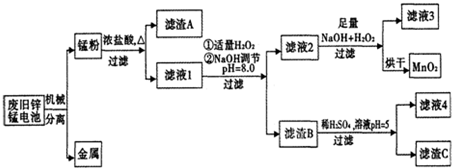
分析 “锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐,向锰粉中加入浓盐酸并加热,发生反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、Zn(OH)2+2HCl=ZnCl2+2H2O、Fe+2HCl=FeCl2+H2↑,然后采用过滤方法得到滤渣A和滤液1,滤渣A中含有MnOOH、C,滤液1中含有氯化锰、氯化锌、氯化亚铁等,向滤液中加入少量双氧水,发生反应为Mn2++H2O2+2OH-=MnO2↓+2H2O、Fe2++2H++H2O2=Fe 3++2H2O,加入NaOH溶液调节溶液pH=8.0,根据表中数据知,Fe3+、Zn2+完全沉淀而除去;然后过滤,向滤液2中加入足量NaOH和双氧水,然后过滤得到固体MnO2,
向滤渣B中加入稀硫酸并调节溶液的pH=5,得到的沉淀是Fe(OH)3,Zn(OH)2溶解,过滤得到的滤液4溶液主要成分是硫酸锌,滤渣C是Fe(OH)3,
(1)加入NaOH溶液调节pH=8.0,目的是除去锌、铁离子;常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=c(OH-)2.c(Zn 2+);
(2)滤液1中加入H2O2的作用是氧化亚铁离子便于除去铁离子;
(3)滤液2中的Mn2+被双氧水氧化生成MnO2时同时生成水;
(4)滤渣B中氢氧化锌与稀硫酸在pH=5时反应生成硫酸锌和水;
(5)从滤液中得到晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法;
(6)电解K2MnO4溶液时,阳极上锰酸根离子失电子发生氧化反应、阴极上氢离子放电生成氢气.
解答 解:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐,向锰粉中加入浓盐酸并加热,发生反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、Zn(OH)2+2HCl=ZnCl2+2H2O、Fe+2HCl=FeCl2+H2↑,然后采用过滤方法得到滤渣A和滤液1,滤渣A中含有MnOOH、C,滤液1中含有氯化锰、氯化锌、氯化亚铁等,向滤液中加入少量双氧水,发生反应为Mn2++H2O2+2OH-=MnO2↓+2H2O、Fe2++2H++H2O2=Fe 3++2H2O,加入NaOH溶液调节溶液pH=8.0,根据表中数据知,Fe3+、Zn2+完全沉淀而除去;然后过滤,向滤液2中加入足量NaOH和双氧水,然后过滤得到固体MnO2;
向滤渣B中加入稀硫酸并调节溶液的pH=5,得到的沉淀是Fe(OH)3,Zn(OH)2溶解,过滤得到的滤液4溶液主要成分是硫酸锌,滤渣C是Fe(OH)3,
(1)根据表中数据知,加入NaOH溶液调节pH=8.0,铁离子和锌离子都转化为氢氧化物沉淀,所以目的是使Fe3+、Zn2+完全沉淀而除去;
常温下c(OH-)=10-6 mol/L,c(Zn 2+)=10-5 mol/L,所以Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=c(OH-)2.c(Zn 2+)=(10-6)2.10-5=1.0×10-17,
故答案为:使Fe3+、Zn2+完全沉淀而除去; 1.0×10-17;
(2)滤液1中加入H2O2的作用是Fe2+全部氧化为Fe3+,故答案为:Fe2+全部氧化为Fe3+;
(3)滤液2中的Mn2+被双氧水氧化生成MnO2时同时生成水,离子反应方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,故答案为:Mn2++H2O2+2OH-=MnO2↓+2H2O;
(4)滤渣B中氢氧化锌与稀硫酸在pH=5时反应生成硫酸锌和水,反应方程式为Zn(OH)2+H2SO4=ZnSO4+2H2O,故答案为:Zn(OH)2+H2SO4=ZnSO4+2H2O;
(5)从滤液中得到晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,所以工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体,
故答案为:蒸发浓缩;冷却结晶;过滤;
(6)电解K2MnO4溶液时,阳极上锰酸根离子失电子发生氧化反应,电极反应为:2MnO42--2e-=2MnO4-,阴极上氢离子放电生成氢气,电池反应式为2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2KOH+H2↑,
故答案为:2MnO42--2e-=2MnO4-.
点评 本题考查混合物的分离和提纯,为高频考点,涉及电解原理、离子反应、氧化还原反应、溶度积常数有关计算等知识点,侧重考查基本操作及基本原理,明确实验原理是解本题关键,知道流程图中发生的反应、基本操作,注意(1)中氢氧根离子浓度计算方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=-485 kJ•mol - 1 | |
| B. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=+485 kJ•mol - 1 | |
| C. | 2H 2(g)+O 2(g)═2H 2O(g)△H=+485 kJ•mol - 1 | |
| D. | 2H 2(g)+O 2(g)═2H 2O(g)△H=-485 kJ•mol - 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 利用核磁共振氢谱可以鉴别1-丙醇和2-丙醇 | |
| C. | 溴苯水解后,滴加硝酸酸化的硝酸银溶液检验水解产物中的溴离子 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③④⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中的官能团有羟基、碳碳双键、醚键、酯基 | |
| B. | 若R为乙基则该物质的分子式可以表示为C16H14O7 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与7mol Br2完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备:
乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备: ),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.
),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,可作双氧水分解的氧化剂 | |
| B. | 浓硫酸具有较强酸性,常用作淀粉水解的催化剂 | |
| C. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它的一氯代物有9种(不考虑立体异构) | |
| B. | 它的分子中最多有7个原子共平面 | |
| C. | 一定条件下,它分别可以发生加成、取代、氧化、还原反应 | |
| D. | 它和丁基苯(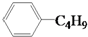 )互为同分异构体 )互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com