
苯甲酸钠(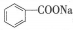 ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A–)不变
C.当pH为5.0时,饮料中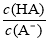 =0.16
=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(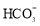 )+c(
)+c(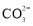 )+c(OH–)–c(HA)
)+c(OH–)–c(HA)
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(新课标1卷精编版) 题型:选择题
下列关于有机化合物的说法正确的是
A.2-甲基丁烷也称为异丁烷
B.由乙烯生成乙醇属于加成反应
C.C4H9Cl有3种同分异构体
D.油脂和蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷精编版) 题型:填空题
随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)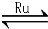 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
____________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷精编版) 题型:选择题
已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是
A. 原子半径:X>Y>Z>W
B. W的含氧酸的酸性比Z的含氧酸的酸性强
C. W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D. 若W与X原子序数差为5,则形成化合物的化学式为X3W2
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(浙江卷精编版) 题型:实验题
无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
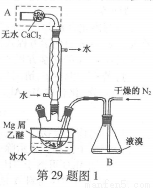
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
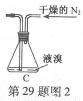
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(浙江卷精编版) 题型:选择题
下列说法不正确的是
A. 储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量
B. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
C. Ba2+浓度较高时危害健康,但BaSO4可服入体内,作为造影剂用于X-射线检查肠胃道疾病
D. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(江苏卷精编版) 题型:实验题
以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:

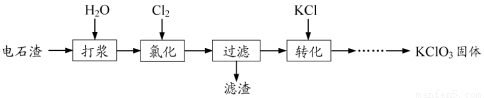
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。

①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g?L-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高一下期末化学试卷(解析版) 题型:实验题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:
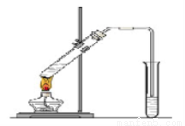
(1)写出制取乙酸乙酯的化学反应方程式: 。
(2)饱和碳酸钠溶液的主要作用是: 。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是: 。
(4)应结束后,振荡试管b,静置。观察到的现象是 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是(填名称): 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高二下期末化学试卷(解析版) 题型:选择题
漆酚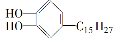 是漆的主要成分。下列说法中不属漆酚性质的是( )
是漆的主要成分。下列说法中不属漆酚性质的是( )
A.可以与H2发生加成反应
B.可以使高锰酸钾酸性溶液褪色
C.可以与碳酸钠溶液反应放出二氧化碳
D.可以与FeCl3溶液有显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com