
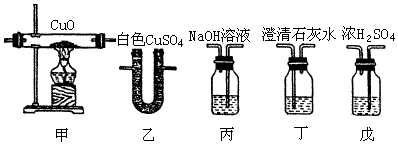
分析 (1)由于水煤气中原来就混有CO2和H2O,所以必须先把它们除去,以排除干扰,除去CO2的试液有NaOH溶液和Ca(OH)2饱和溶液(石灰水),其中,NaOH易溶于水,溶液较浓,而Ca(OH)2的溶解度很小,其饱和溶液仍是很稀的溶液,所以用NaOH溶液吸收CO2,而用石灰水检验CO2.吸收H2O的试剂有浓H2SO4和无水CuSO4,其中浓H2SO4的吸水性比无水CuSO4强,所以用浓H2SO4吸收H2O,而用无水CuSO4检验H2O.据此确定连接顺序;
(2)A、无水硫酸铜遇水变蓝,可用来检验水的存在;
B、氢氧化钠溶液可吸二氧化碳;
C、澄清石灰水可用来检验二氧化碳的生成;
D、浓硫酸用作干燥剂,可用来吸收水分;
(3)丙中用氢氧化钠除去水煤气中的二氧化碳,生成碳酸钠和水,丁中是用澄清石灰水检验水煤气与氧化铜反应后生成的二氧化碳,根据电荷守恒书写反应的离子方程式.
解答 解:1.(1)确定装置顺序:由于混合气在通过NaOH溶液时会带出少量水分,所以应先除去CO2,再除去H2O,然后使除去CO2和H2O后的气体通过灼热的CuO.反应后生成的混合气体,先通过无水
CuSO4验证H2O的生成,再通过澄清的石灰水验证CO2的生成.如果先通过石灰水,由于会带出少量水分而干扰水的检验.所以装置顺序应为:丙→戊→甲→乙→丁,
故答案为:丙→戊→甲→乙→丁;
(2)A、无水硫酸铜遇水变蓝,如果无水硫酸铜变蓝,就说明有水生成,也就是说,水煤气中含有H2,
故答案为:通过检验产生的水,来检验氢气;
B、为除去水煤气中的二氧化碳,防止干扰一氧化碳的检验,我们可选用丙装置,其中的氢氧化钠溶液可吸二氧化碳,
故答案为:除去水煤气中的二氧化碳,防止干扰一氧化碳的检验;
C、澄清石灰水遇二氧化碳变浑浊,所以我们可以利用丁来验证CO2的生成,进而证明水煤气中有CO,
故答案为:通过检验产生的二氧化碳,来检验一氧化碳;
D、浓硫酸可吸收水分,我们可以用戊装置除去水煤气中的水蒸气,防止干扰氢气的检验,
故答案为:除去水煤气中的水蒸气,防止干扰氢气的检验.
(3)丙中用氢氧化钠除去水煤气中的二氧化碳,生成碳酸钠和水,反应的离子方程式为CO2+2OH-=H2O+CO32-,丁中是用澄清石灰水检验水煤气与氧化铜反应后生成的二氧化碳,根反应的离子方程式为CO2+Ca2++2OH-=H2O+CaCO3↓,
故答案为:CO2+2OH-=H2O+CO32-;CO2+Ca2++2OH-=H2O+CaCO3↓.
点评 本题主要考查物质的检验与分离,要求学生能根据物质的性质灵活运用于实验方案的设计,解题时根据题给装置和CO、H2的性质,首先确定检验CO和H2的方法,一般采用间接检验法;CO与CuO反应生成Cu和CO2,H2与CuO反应生成Cu和水;CO2可使澄清石灰水变浑浊,H2O可使无水CuSO4变蓝,根据这两种现象可以证明CO2和水的存在,也就间接证明CO和H2的存在,题目难度中等级.


科目:高中化学 来源: 题型:选择题
 乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )
乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )| A. | 在其他条件不变时,途径Ⅰ与途径Ⅱ中乙醛的转化率相同 | |
| B. | 途径Ⅱ是加入催化剂时能量变化曲线,且催化剂是I2 | |
| C. | 途径Ⅰ与途径Ⅱ的焓变(△H)相同 | |
| D. | 加入催化剂将增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.5 | B. | 17 | C. | 22 | D. | 34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 硝酸铵溶于水温度降低,这个过程吸热热量 | |
| C. | 同温同压下,H2和Cl2在光照和点燃条件下的△H不同 | |
| D. | 自发反应的熵一定增大,非自发反应的熵一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O | C. | NO2 | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
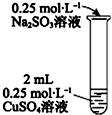 | i有黄色沉淀出现,随着Na2SO3溶液的滴入,沉淀增加,当加到5mL时,溶液的蓝色消失. ii将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生. iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当加到10mL时,沉淀完全溶解,得无色溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Mg2+、Ag+、CO32-、Cl- | ||
| C. | K+、NH4+、SO42-、Cl- | D. | K+、Na+、NO3-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com