
| A. | 原子半径比钾的原子半径大 | B. | 氯化物难溶于水 | ||
| C. | 其氢氧化物的碱性比NaOH强 | D. | 碳酸盐难溶于水 |
分析 第4周期某主族元素的原子,它的最外电子层上有2个电子,则为第IIA族元素,所以是Ca元素,结合元素周期率的递变性和相似性解答该题.
解答 解:第4周期某主族元素的原子,它的最外电子层上有2个电子,则为第IIA族元素,所以是Ca元素,
A.同周期原子半径从左到右逐渐减小,所以原子半径比钾的原子半径小,故A错误;
B.氯化钙易溶于水,故B错误;
C.氢氧化钠为强碱,而氢氧化钙为中强碱,氢氧化钠碱性较强,且钠的金属性较强,对应的氢氧化氢的碱性也较强,故C错误;
D.碳酸钙难溶于水,故D正确;
故选D.
点评 本题考查了周期表的结构及元素推断,为高频考点,侧重于学生的分析能力的考查,注意把握周期表中元素性质的递变规律,题目难度一般.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 元素 | 特征 |
| X | 周期表中,原子半径最小 |
| Y | 常温下,可以形成Y2、Y3型的气体单质 |
| Z | 其原子内层电子与最外层电子数之比为10:1 |
| W | 最高化合价为+6 |
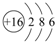 .
.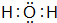 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:填空题
四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学等多个领域潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是
3Fe2+2S2O +O2+xOH-
+O2+xOH- Fe3O4↓+S4O
Fe3O4↓+S4O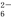 +2H2O。
+2H2O。
请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________________,S2O 中S的化合价为________________.
中S的化合价为________________.
(2)反应的化学方程式中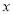 =____________.
=____________.
(3)每生成 1mol Fe3O4,反应转移的电子为_________mol,被Fe2+还原的O2的物质的量为________mol.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
下列叙述正确的是
A.NaCl固体可导电
B.NaHSO4溶于水电离出H+,则NaHSO4属于酸
C.HCl溶于水能导电,但 液态HCl不能导电
液态HCl不能导电
D.导电能力强的溶液里能够自由移动的离子数目一定比导电能力弱的溶液里能够自由移动的离子数目多
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
NaCl、NaClO、NaClO3的混合物中,已知Na的质量分数为23%,则氧元素的质量分数为
A.21.5% B.45.1% C.31.0% D.41.5%
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:实验题
信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
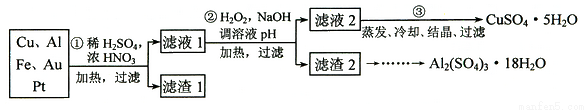
(1) 第①步Cu与酸反应的离子方程式为 。
(2) 第②步加H2O2的作用是 。
(3) 该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定(原理为I2+2S2O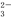 ===2I-+S4O
===2I-+S4O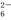 ),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 滴定过程中可选用________作指示剂,滴定终点的现象是____________。
② CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标
准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+。
③ 写出计算CuSO4·5H2O质量分数的表达式w=___________。
(4)请补充完整从滤渣2制备Al2(SO4)3·18H2O的实验方案:边搅拌边向滤渣2中加入_________至滤渣不再溶解,过滤, 在滤液中 、过滤、用水洗涤固体2-3次,在50℃下干燥,得到Al2(SO4)3·18H2O。(可选试剂有:硫酸溶液、氢氧化钠溶液、氨水、二氧化碳)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com