
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

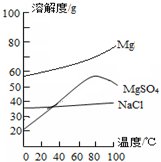
分析 盐泥中含有NaCl、Mg(OH)2、CaCO3、BaSO4、SiO2等,加入酸溶解NaCl、Mg(OH)2、CaCO3溶于硫酸生成硫酸钙和硫酸镁,过滤后得滤饼为BaSO4、SiO2,在母液中通蒸汽进行蒸发浓缩,使部分氯化钠析出,过滤后将滤液冷却结晶使硫酸镁晶体析出,再经过滤、洗涤、干燥可得MgSO4•7H2O,
(1)反应器中加入酸溶解,Mg(OH)2、CaCO3溶于硫酸生成硫酸钙和硫酸镁;
(2)CaCO3+H2SO4?CaSO4+H2CO3,加热有H2CO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4,所以在滤饼中检测到硫酸钙的成分;
(3)在滤液I中通入高温水蒸气进行蒸发结晶,主要目的是使氯化钠能析出但硫酸镁不能析出,据此判断控制的温度;
(4)步骤II的目的是从硫酸镁溶液中获得硫酸镁晶体,由于硫酸镁晶体带有结晶水,且根据硫酸镁的溶解度受温度影响的情况可知,要用冷却结晶的方法获得;
(5)步骤III是潮湿的晶体得到七水硫酸镁晶体,可以用真空干燥器;
(6)结合MgSO4•7H2O~Mg(OH)2~2NaOH计算.
解答 解:(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,Mg(OH)2、CaCO3溶于硫酸生成硫酸钙和硫酸镁,反应的化学方程式为:
Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4?CaSO4+H2O+CO2↑,
故答案为:Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4?CaSO4+H2O+CO2↑.
(2)在滤饼中检测到硫酸钙的成分是因为CaCO3+H2SO4?CaSO4+H2CO3,加热有H2CO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4,
故答案为:因为CaCO3+H2SO4?CaSO4+H2CO3,加热有H2CO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4;
(3)在滤液I中通入高温水蒸气进行蒸发结晶,主要目的是使氯化钠能析出但硫酸镁不能析出,图象中溶解度分析可知选择80°C硫酸镁溶解度最大,
故答案为:80;
(4)步骤II的目的是从硫酸镁溶液中获得硫酸镁晶体,由于硫酸镁晶体带有结晶水,且根据硫酸镁的溶解度受温度影响的情况可知,要用冷却结晶的方法获得晶体,步骤II操作是冷却结晶、洗涤,得到潮湿的晶体,
故答案为:冷却结晶、洗涤;
(5)步骤III是潮湿的晶体得到七水硫酸镁晶体,可以用真空干燥器,真空干燥MgSO4•7H2O晶体防止失去结晶水,
故答案为:D;
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则
MgSO4•7H2O~Mg(OH)2~2NaOH,
1 2
n (V1mL×c1mol/L-V2mL×c2mol/L)×10-3L/ml
n=0.5×(V1mL×c1mol/L-V2mL×c2mol/L)×10-3L/ml=5×10-4×(c1V1-c2V2)mol
MgSO4•7H2O的质量分数=$\frac{5×1{0}^{-4}({c}_{1}{V}_{1}-{c}_{2}{V}_{2})mol×246g/mol}{ag}$×100%=$\frac{12.3({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{a}$%.
故答案为:$\frac{12.3({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{a}$%.
点评 本题考查物质的分离提纯,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
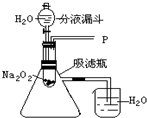 水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:| 实验步骤 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中的Na2O2既表现氧化性,又表现还原性 | |
| B. | 反应每消耗1molSO2,Na2O2将得到2mol电子 | |
| C. | 与反应2Na2O2+CO2═2Na2CO3+O2中Na2O2的作用相同 | |
| D. | 与反应Na2O2+H2SO4═Na2SO4+H2O2中Na2O2的作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
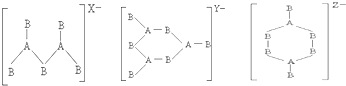
| A. | 2,3,4 | B. | 4,3,2 | C. | 4,2,3 | D. | 3,2,4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.42 |
| Ⅲ | 0.00 | 19.92 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于反应2AB(g)?A2(g)+B2(g),当容器中AB与A2的体积比不随时间变化,说明反应一定达到平衡状态 | |
| B. | 对于反应N2(g)+3H2(g)?2NH3(g),当1个N≡N键断裂的同时3个H-H键形成,说明反应一定达到平衡状态 | |
| C. | 在恒温,恒容密闭容器中如下反应:2HI(g)?H2(g)+I2(g)混合气体颜色不在变化,说明反应一定达到平衡 | |
| D. | 在恒温,恒容密闭容器中如下反应:X2(g)+Y2(g)?2Z(g)+W(s),当混合气体的平均相对分子质量或压强不随时间的变化而变化,说明反应一定达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大容器体积 | B. | 通入大量O2 | C. | 移去部分SO2 | D. | 降低体系温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com