
已知25℃时一些难溶物质的溶度积常数如下:
化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
根据上表数据,判断下列化学方程式不正确的是
A.2AgCl+Na2S═2NaCl+Ag2S
B.MgCO3+H2O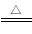 Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
C.ZnS+2H2O═Zn(OH)2+H2S↑
D.Mg(HCO3)2+2Ca(OH)2═Mg(OH)2↓+2CaCO3↓+2H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届河北省高三上11月月考化学卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
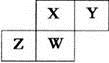
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g) ΔH=Q kJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g) ΔH=Q kJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol, 则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0. 12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量0.025Q kJ时,生成的HCl通入含0. 1 mol NaOH的溶液恰好反应
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2 = 4B2O 3 + 2V2O5,下列说法正确的是
3 + 2V2O5,下列说法正确的是
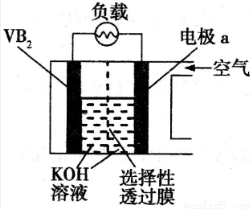
A.电极a为电池负极,发生还原反应
B.每消耗1molVB2转移6mol电子
C.电池工作时,OH‑向电极a移动
D.VB2极发生的电极反应为:2VB2+22OH?-22e?=V2O5+2B2O3+11H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:实验题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL0.2 mol·L-1的醋酸溶液,用0.2mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250mL0.2mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、____________和______________。
(2)为标定某醋酸溶液的准确浓度,用0.2000mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为____________。(保留小数点后四位)
实验二: 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
醋酸溶液浓度(mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是__________。
(2)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度________(填“增大”“减小”或“不变”)。
实验三: 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
把0.6molX气体和0.4molY气体混合于2L容器中使它们发生如下反应反应: 3X(g)+Y(g)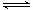 nZ(g)+2W(g);5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应速率为0.01 mol/( L·min),则上述反应中Z气体的反应方程式中化学计量系数n的值是
nZ(g)+2W(g);5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应速率为0.01 mol/( L·min),则上述反应中Z气体的反应方程式中化学计量系数n的值是
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
在恒温条件下,欲使CH3COONa的稀溶液中c(CH3COO)/(Na+)比值增大,可在溶液中加入少量下列物质中的
①固体NaOH ②固体KOH ③固体NaHS ④固体CH3COONa ⑤冰醋酸
A.只有①② B.只有③⑤ C.只有②④⑤ D.只有①⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海省高二11月月考化学试卷(解析版) 题型:选择题
某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。 下列有关说法不正确的是( )
下列有关说法不正确的是( )

A.反应2min末X的浓度为0.35mol/L
B.该反应的化学方程式可表示为:2Z 2Y+3X
2Y+3X
C.反应2min内以Z浓度变化表示的平均反应速率为0.05mol/(L•min)
D.任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2 C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是
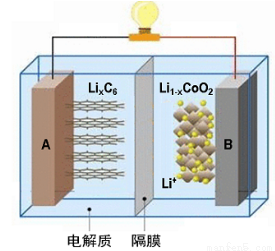
A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边
B.充电时,A为阴极,发生还原反应
C.放电时,B为正极,电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2
D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com