
【题目】己烯雌酚(结构简式如下图所示),是一种激素类药物。下列叙述不正确的是
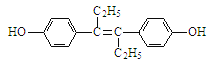
A. 己烯雌酚的分子式为C18H20O2
B. 己烯雌酚与NaOH溶液、NaHCO3溶液均能反应
C. 1 mol己烯雌酚最多能与2 mol Na发生反应
D. 己烯雌酚与饱和溴水可以发生加成反应和取代反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 稀硫酸溶液与氢氧化钡溶液恰好中和: Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O
B. 金属钠投入硫酸镁溶液中: 2Na+2H2O +Mg2+=2Na++H2↑+Mg(OH)2↓
C. 碳酸钠溶液中通入过量氯气: CO32﹣+Cl2=CO2↑+Cl-+ClO-
D. 实验室用 MnO2 和浓盐酸制取 Cl2: MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,其结构简式如图: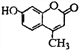 下列说法不正确的是
下列说法不正确的是
A. 羟甲香豆素分子式为C10H8O3
B. 1mol羟甲香豆素最多可以与5mol H2发生加成
C. 1mol羟甲香豆素溶于足量NaOH溶液,最多可消耗3mol NaOH
D. 羟甲香豆素分子中含有酯基、酚羟基、碳碳双键,属于芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇可由乙烯气相直接水合法或间接水合法生产,一些转化如图。

某些物质的有关数据如下表:
熔点/℃ | 沸点/℃ | 水溶性 | |
乙醇 | -114.1 | 78.3 | 易溶 |
乙醛 | -121 | 20.8 | 易溶 |
乙酸乙酯 | -83 | 77.0 | 难溶 |
回答以下问题:
(1)间接水合法中的转化③:乙烯与浓硫酸反应生成硫酸氢乙酯(CH3CH2—OSO3H)的有机反应类型是_____________,转化④的化学方程式是__________________;
(2)蘸有B的玻璃棒遇到氮的最简单氢化物气体会冒白烟,反应的化学方程式为________,转化⑤的化学方程式为______________________________;
(3)将一质量为w的铜丝灼烧变黑后,迅速插入乙醇中,变黑的铜丝恢复红色。
①使铜丝恢复红色的反应的化学方程式为________________________;
②若要证明铜丝起催化作用,还需要进行的操作是_______________;
(4)已知:CH3CHO + NaHSO3 →![]() ↓(α-羟基乙磺酸钠),如上所得乙醛可用如下方式提纯:
↓(α-羟基乙磺酸钠),如上所得乙醛可用如下方式提纯:
![]()
①α-羟基乙磺酸钠的晶体类型为___________________。
②分离操作A的名称是________________;
③某同学设计分离操作B的装置(夹持和加热装置已略去)如图所示。冷凝管中的液体应从_____口进。(填“D”或“E”)

下列有关操作与装置的分析,正确的是_____。(填字母,多选反扣)
A.烧杯中应装冰水
B.冷凝管应通温水
C.图示装置可用于除去乙酸乙酯中混有的乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前36号元素A、B、C、D、E原子序数依次增大,A与B是同一周期紧邻元素,B与D同一主族,B元素氢化物的水溶液可用于玻璃的雕刻。C元素是同周期元素中第一电离能最小的元素,C与E的最外层电子数相同,E元素内层均排满电子。
(1)基态原子E的电子排布式为___________;依据电子排布周期表划分为5个区,该元素位于周期表的_________区。
(2)元素A、B、D电负性由大到小的顺序为___________。
(3)D2A分子中,中心原子的杂化方式为___________。分子键角大小关系,AB2分子_____D2A分子(填“大于”,“小于”或“等于”),原因_________________________。
(4)单质C经常用于储氢,储氢后形成晶体结构如图所示:
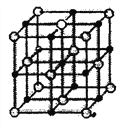
该晶体中与C离子近邻的氢离子有_______个。这些氢离子,构成的空间构型为_______。已知C离子与氢离子之间最近的核间距为a pm,则该晶体的密度为_____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. a—定由W、X两种元素组成
D. 图中转化过程d物质在作为反应物时均即为氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
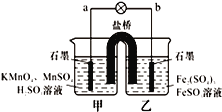
A. 外电路的电流方向是从a到b
B. 甲烧杯中溶液的pH逐渐减小
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. 乙烧杯中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S为二元弱酸。20 ℃时,向0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A. 通入HCl气体之前: c(S2-)>c(HS-)>c(OH-)>c(H+)
B. c(HS-)=c(S2-)的碱性溶液中: c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
C. pH=7的溶液中: c(Cl-)=c(HS-)+2c(H2S)
D. c(Cl-)=0.100 mol·L-1的溶液中: c(OH-)-c(H+)=c(H2S)-c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A. 该溶液的pH=4 B. 升高温度,溶液的pH和电离平衡常数均减小
C. 此酸的电离平衡常数约为1×10-7 D. 加入少量纯HA,电离程度减小电离平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com