
分析 (1)发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,计算二氧化硫物质的量,根据方程式计算生成硫酸铜的物质的量;
(2)根据硫元素守恒计算反应后溶液中n(SO42-),再根据c=$\frac{n}{V}$计算SO42-的物质的量浓度.
解答 解:(1)发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,生成二氧化硫物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,根据方程式可知生成硫酸铜的物质的量为0.1mol,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;0.1mol;
(2)根据硫元素守恒,反应后溶液中n(SO42-)=0.05L×18mol/L-0.1mol=0.8mol,则稀释后SO42-的物质的量浓度为$\frac{0.8mol}{0.5L}$=1.6mol/L,
故答案为:1.6mol/L.
点评 本题考查化学方程式计算,难度不大,注意利用守恒法计算反应后硫酸根的物质的量.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ⑤②③ | B. | ④②③ | C. | ⑤②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
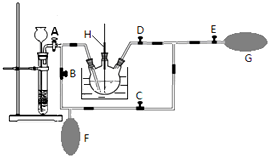
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
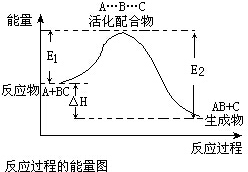
| A. | 反应物的键能总和比生成物的键能总和高 | |
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | |
| C. | 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应 | |
| D. | 使用合适的催化剂能同时降低E1和E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.2mol/L CaCl2溶液中含Cl-数为0.2×6.02×1023 | |
| B. | 22gCO2含有0.5mol CO2分子,体积为11.2L | |
| C. | 3.01×1023个水分子的摩尔质量为9g/mol | |
| D. | 3.2g O2和3.2g O3含氧原子的数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com