
【题目】铜铁及其化合物在日常生活和工业生产中有着重要用途。
(1)铁制炊具在潮湿的空气中易发生吸氧腐蚀而生锈,负极的电极反应式为:___,正极的电极反应式为:___。
(2)下列哪些装置可防止铁棒被腐蚀___。(填正确答案标号)
A.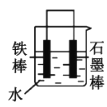 B.
B.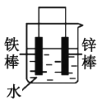 C.
C.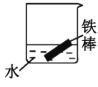 D.
D.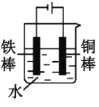
(3)高铁酸钾(K2FeO4)广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如图:
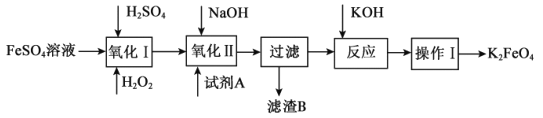
查阅资料:K2FeO4在水中溶解度很大,在碱性环境中稳定,在中性和酸性条件下不稳定。
①“氧化I”中,生成Fe3+的离子反应方程式是___。
②净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4+ H2O= Fe(OH)3↓+ KOH+ 。___。
(4)工业上常以铜做阳极,石墨做阴极,电解含有NaOH的NaCl水溶液制备Cu2O。
已知:该电解过程中阳极先生成难溶物CuCl,再与NaOH反应转化为Cu2O。
①写出阳极的电极反应式___,该过程中生成Cu2O的离子反应方程式为___。
②如果电解后溶液体积未发生变化,电解后溶液中的c(OH-)会___(填“变大”“变小”或“不变”)。
③若电解时电路中通过0.2mol电子,理论上生成Cu2O的质量为___g。
【答案】Fe-2e-=Fe2+ O2+4e-+2H2O=4OH- BD H2O2+2H++2Fe2+=2Fe3++2H2O 4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2↑ Cu+Cl--e-=CuCl 2CuCl+2OH-=Cu2O+2Cl-+H2O 不变 14.4
【解析】
(1)铁制品是铁合金,在潮湿的空气中易发生吸氧腐蚀而生锈,铁作负极被氧化,正极上是氧气得电子被还原;
(2)铁为活泼金属,易发生电化学腐蚀;若铁为原电池的正极,比铁活泼的金属作负极,可防止铁被腐蚀;若铁为外接电源的负极,为外加电流的阴极保护法,可防止铁被腐蚀;
(3)以钛白粉生产的副产品FeSO4制备高铁酸钾,由制备流程可知,I中亚铁离子与过氧化氢发生氧化还原反应生成铁离子,II中发生3NaClO+Fe2(SO4)3+10NaOH=2Na2FeO4↓+3NaCl+3Na2SO4+5H2O,过滤分离出NaCl、Na2SO4,再加KOH发生Na2FeO4+2KOH=K2FeO4+2NaOH,操作I中包括冷却结晶,过滤洗涤、干燥几个步骤,洗涤选择乙醇,防止高铁酸钾溶解而损失,以此来解答;
(4)①电解池中阳极发生氧化反应,铜失去1个电子与氯离子结合生成氯化亚铜沉淀,据此写出阳极反应方程式;氯化亚铜与氢氧化钠反应生成氧化亚铜、氯化钠和水;
②根据阴极、阳极的反应式分析;
③电解电路中通过0.2mol电子,理论上生成Cu2O也为0.2mol,再计算质量。
(1)铁制品是铁合金,在潮湿的空气中易发生吸氧腐蚀而生锈,铁作负极被氧化,正极上是氧气得电子被还原,则负极的电极反应式为:Fe-2e-=Fe2+,正极的电极反应式为:O2+4e-+2H2O=4OH-;
(2)A.图中铁碳形成原电池反应,铁为负极,碳为正极,为铁的吸氧腐蚀,故A不符合题意;
B.锌比铁活泼,铁为正极,被保护而难以腐蚀,故B符合题意;
C.水中溶解氧气,铁可发生电化学腐蚀,正极反应式:O2+2H2O+4e-=4OH-,负极反应式:Fe-2e-=Fe2+,故C不符合题意;
D.电解池中铁棒是阴极,铜棒是阳极,铁棒得到了保护,故D符合题意;
答案选BD;
(3)①氧化Ⅰ中,生成Fe3+的离子反应方程式为H2O2+2H++2Fe2+=2Fe3++2H2O;
②净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,由电子、电荷守恒可知反应的方程式为4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2↑;
(4)①铜作阳极,石墨作阴极,在含有NaOH的NaCl水溶液中电解,在阳极生成难溶CuCl,再与NaOH反应转化为Cu2O,阳极电极反应式为:Cu+Cl--e-=CuCl;氯化亚铜与氢氧化钠反应生成氧化亚铜、氯化钠和水,离子反应为:2CuCl+2OH-=Cu2O+2Cl-+H2O;
②阳极电极反应式为:2Cu+2Cl--2e-=2CuCl;阴极反应式为:2H2O+2e=H2↑+2OH,2CuCl+2OH-=Cu2O+2Cl-+H2O,转移电子数相等,则产生和消耗的OH物质的量相等,则电解后溶液中c(OH)不变;
③若电解电路中通过0.2mol电子,根据Cu+Cl--e-=CuCl,生成0.2mol CuCl,根据2CuCl+2OH-=Cu2O+2Cl-+H2O,理论上生成Cu2O的物质的量为0.1mol,则质量为0.1mol×144g/mol=14.4g。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
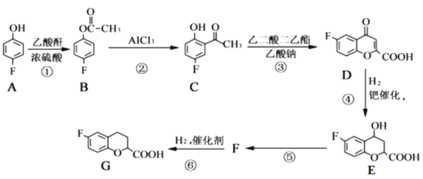
已知:乙酸酐的结构简式为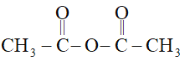
请回答下列问题:
(1)A的名称是__________;B中所含官能团的名称是__________。
(2)反应⑤的化学方程式为__________________,该反应的反应类型是______________。
(3)G的分子式为________________,乙酸酐共面的原子最多有_________个。
(4)写出同时满足下列条件的E的同分异构体的结构简式:________________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.![]() 该物质与足量
该物质与足量![]() 溶液反应生成
溶液反应生成![]()
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备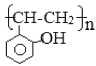 的合成路线流程图(无机试剂任选),合成路线流程图示例如下:
的合成路线流程图(无机试剂任选),合成路线流程图示例如下:
![]()
__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH溶液为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.右图是一个电化学过程的示意图.已知甲池的总反应式为: 2CH3OH+3O2+4KOH![]()
![]() 2K2CO3+6H2O
2K2CO3+6H2O
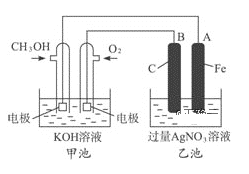
请填空:
(1)充电时:①燃料电池的正极与电源______极相连.
②阳极的电极反应式为__________________________________.
(2)放电时:负极的电极反应式为______________________________.
(3)在此过程中若完全反应,乙池中A极的质量增加324g,则甲池中理论上消耗O2______L(标准状况下).
(4)工业上用3克氢气与足量二氧化碳反应生成气态甲醇(CH3OH)和水蒸气,放出24.5千焦的热量,请写出该反应的热化学反应方程式:_________________________.
(5)用该电池为电源电解氯化镁制取金属镁,消耗甲醇1.6g,可制得金属镁______g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代技术可利用电解法制H2O2并用产生的H2O2处理废氨水,其装置如图所示。下列说法正确的是( )
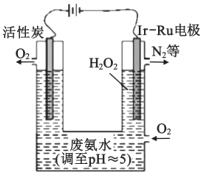
A.该过程的总反应为:3H2O2+8H++4NH3H2O=8H2O+N2↑+2NH4+
B.Ir-Ru惰性电极有吸附O2的作用,该电极上的反应为:O2+2H++2e-=H2O2
C.理论上电路中每转移6mol电子,最多可以处理NH3H2O的物质的量为1mol
D.为了不影响H2O2的产量,需要向废氨水中加入适量硝酸调节溶液的pH约为5,则所得的废氨水溶液中c(NH4+)>c(NO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
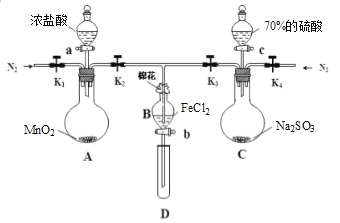
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________________________________________。
(2)棉花中浸润的溶液为________________,作用是_____________________________________________ 。
(3)A中发生反应的化学方程式________________________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是________________________________________,用________(写试剂化学式)检验氧化产物,现象是____________________________________________ 。
(5)能说明氧化性Fe3+>SO2的离子方程式是_______________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以废铜屑(含少量Fe、不溶性杂质)为原料制取CuSO4·5H2O晶体和[Cu(NH3)4]SO4·H2O晶体,其实验流程如下:
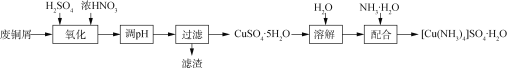
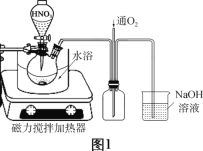
(1)氧化时先加入一定量3 mol/L H2SO4,再调节浓硝酸的用量至![]() 为2.0左右时,铜粉和浓硝酸完全反应,主要反应的化学方程式为_______。
为2.0左右时,铜粉和浓硝酸完全反应,主要反应的化学方程式为_______。
硝酸过量对产品的影响为________________________________。
(2)废铜屑的氧化在如图1所示的装置中进行。从长导管中通入氧气的作用是___________。保持试剂的用量不变,实验中提高Cu转化率的操作有____________(写一种)。
(3)调节溶液pH应在3.5~4.5范围的原因是______________________。
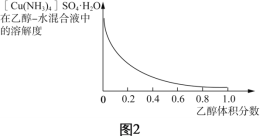
(4)已知:[Cu(NH3)4]2+![]() Cu2++4NH3;CuSO4、(NH4)2SO4难溶于乙醇。结合图2,[Cu(NH3)4]SO4·H2O在乙醇水混合液中的溶解度随乙醇浓度变化曲线,补充完整由加足量氨水后所得的[Cu(NH3)4]SO4溶液制备[Cu(NH3)4]SO4·H2O晶体的实验方案:______________ (实验中必须使用的试剂和仪器:无水乙醇、乙醇-水混合液、BaCl2溶液、真空干燥箱)。
Cu2++4NH3;CuSO4、(NH4)2SO4难溶于乙醇。结合图2,[Cu(NH3)4]SO4·H2O在乙醇水混合液中的溶解度随乙醇浓度变化曲线,补充完整由加足量氨水后所得的[Cu(NH3)4]SO4溶液制备[Cu(NH3)4]SO4·H2O晶体的实验方案:______________ (实验中必须使用的试剂和仪器:无水乙醇、乙醇-水混合液、BaCl2溶液、真空干燥箱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
B.用FeCl3腐蚀印刷电路板:Cu+Fe3+=Cu2++Fe2+
C.在碳酸氢钙溶液中加入少量苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.Fe与水蒸气反应:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是

A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
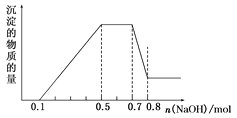
A.溶液中一定不含CO32-,可能含有SO42-和NO3-
B.在滴加NaOH溶液物质的量为0.5~0.7mol时,发生离子反应为Al3++4OH-=AlO2-+2H2O
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(NH4+)∶n(Mg2+)=2∶4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com