
【题目】已知空气﹣锌电池的电极反应为锌片:Zn+2OH﹣﹣2e﹣=ZnO+H2O;碳棒:O2+2H2O+4e﹣=4OH﹣ , 据此判断,锌片是( )
A.正极,被还原
B.正极,被氧化
C.负极,被还原
D.负极,被氧化
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】现有H2、CO(体积比为3∶2)的混合气体a L,在相同条件下,当其完全燃烧时所需O2体积为( )
A.0.5 a L B.a L C. 2 a L D.3 a L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是最重要的化工生产之一,回答下列问题:
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g) ![]() CO2(g) + H2(g) △H<0,在 850℃时,平衡常数 K=1。
CO2(g) + H2(g) △H<0,在 850℃时,平衡常数 K=1。
(1)若升高温度到950℃时,达到平衡时K_________1(填“>”“<”或“ = ”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和xrnolH2,则:
①当x= 5.0时,上述平衡向_________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是_____________。
(3)在850℃时,若设x=5.0mol和x= 6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a_______b(填“大于”、“小于”或“等于”)。
II.氨和尿素【CO(NH2)2】溶液都可以吸收硝酸工业尾气中的NO、NO2,将其转化为N2。
(4)尿素与NO、NO2三者等物质的最反应为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O
该反应中的氧化剂为________(写化学式)。
若反应生成标况下N2 33.6L,则转移电子的数目为___________。
(5)已知:N2(g)+O2(g)=2NO(g)△H1=akJ ·mol-1
N2(g)+3H2(g) = 2NH3(g) △H2 = bkJ mol-1
2H2(g) +O2(g) = 2H2O(g) △H3=ckJ mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H=__________。
III.(6)合成氨盐也是氨的重要用途,测定其中的含氮量可以采用“甲醛法”。即4NH4++6HCHO (CH2)6N4+4H++6H2O。 现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2g该铵盐溶于水,加入足量的甲醛溶液后,再加人水配成100mL溶液,取出10mL,滴入酚酞后再逐滴滴入0.lmol/L的NaOH溶液,当滴到25mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:

(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr2O7),还原产物是CrCl3,写出A中离子方程式:__________。
(2) B装置有几个作用,分别是除去氯气中的氯化氢、__________。拆去a导管的后果可能是_________________。
(3)装置C的功能是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是______。
① | ② | ③ | ④ | |
I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
II | 碱石灰 | 浓琉酸 | 硅胶 | 氯化钠 |
III | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
(4)证明溴的非金属性比碘强的实验操作和现象是_____________。
(5)D装置进行实验时存在明显不足,它是_________,合适的溶液X是________(从①氢氧化钠溶液②业硫酸钠溶液③亚硫酸氢钠溶液④氯化亚铁溶液⑤硫氢化钠溶液⑥碳酸氢钠溶液中选择)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 13C﹣NMR(核磁共振)、15N﹣NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖.下面有关叙述正确的是( )
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N 与14N 互为同位素
D.232Th转化成233U是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然水中含有的细小悬浮颗粒,下列哪种物质可用作混凝剂进行吸附沉降
A.Cl2 B.活性炭 C.Ca(ClO)2 D.KAl(SO4)2·12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正盐 A 能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、 ②、 ④、 ⑤为无色气体, ⑥为红棕色气体。(已知镁在二氧化碳气体中点燃生成碳单质和氧化镁)
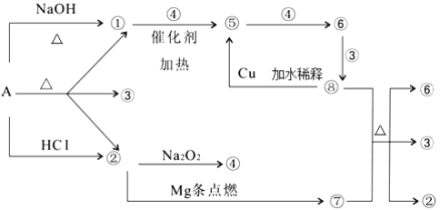
请完成下列各题:
(1)写出化学式 A__________,⑥__________,⑦_________;
(2)写出下列反应化学方程式:
⑧+⑦→②+③+⑥:_______________; ①+④→⑤:______________;
(3)⑧→⑤的离子方程式为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb + PbO2+2H2SO4![]() 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同:据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同:据此回答:
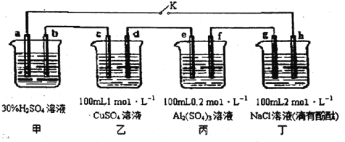
(1) a电极的电极材料是____________________ (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为_____________________。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量是________________。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为_______极,d电极上发生反应的电极反应式为_____________。
(5)电解后取amL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入 bmLCH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。己知CH3COOH 的电离平衡常数为1.75×10-5,则a/b=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com