
| A. | 溶液中c(NH${\;}_{4}^{+}$)=c(Cl-) | |
| B. | 此时水的电离程度最大 | |
| C. | 此时溶液中NH3•H2O的物质的量浓度为 $\frac{1}{2}$(a-0.01)mol/L | |
| D. | 用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
分析 A.反应后溶液为中性,则c(H+)=c(OH-),根据电荷守恒分析;
B.当氨水与盐酸恰好反应时生成氯化铵溶液,铵根离子水解促进了水的电离,此时水的电离程度最大,溶液显示酸性;
C.混合溶液中(Cl-)=0.005mol/L,c(H+)=c(OH-)=10-7mol/L,结合电荷守恒分析;
D.根据Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算NH3•H2O的电离常数.
解答 解:A.已知电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),溶液显中性性,则c(H+)=c(OH-),所以c(NH4+)=(Cl-),故A正确;
B.在一水合氨与氯化氢恰好反应生成氯化铵溶液时,铵根离子在溶液中部分水解,促进了水的电离,水的电离程度最大,溶液显示酸性,当溶液显示中性时,氨水稍稍过量,水的电离程度小于二者恰好反应时水的电离程度,故B错误;
C.溶液中(Cl-)=0.005mol/L,c(H+)=c(OH-)=10-7mol/L,已知电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),则c(NH4+)=c(Cl-)=0.005mol/L,所以c(NH3•H2O)=$\frac{a}{2}$mol/L-c(NH4+)=$\frac{a-0.01}{2}$mol/L=$\frac{1}{2}$(a-0.01)mol/L,故C正确;
D.反应后溶液中c(NH4+)=c(Cl-)=0.005mol/L,c(NH3•H2O)=$\frac{a}{2}$mol/L-c(NH4+)=$\frac{a-0.01}{2}$mol/L=$\frac{1}{2}$(a-0.01)mol/L,c(OH-)=10-7mol/L,则Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.005×1×1{0}^{-7}}{\frac{1}{2}(a-0.01)}$=$\frac{1{0}^{-9}}{a-0.01}$,故D正确;
故选A.
点评 本题考查了酸碱混合的定性判断及定量计算,题目难度稍大,明确溶液中的电荷守恒、电离常数的计算是解答本题关键,注意把握溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及化学计算能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
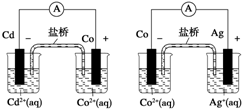
| A. | 2Ag+(aq)+Cd(s)═2Ag(s)+Cd2+(aq) | B. | Co2+(aq)+Cd(s)═Co(s)+Cd2+(aq) | ||
| C. | 2Ag(s)+Cd2+(aq)═2Ag+(aq)+Cd(s) | D. | 2Ag+(aq)+Co(s)═2Ag(s)+Co2+(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com