
|
向体积为0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,下列关系错误的是 | |
| [ ] | |
A. |
Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) |
B. |
Va=Vb时:c(CH3COOH)+c(H+)>c(OH-) |
C. |
Va<Vb时:c(CH3COO-)>(K+)>c(OH-)>c(H) |
D. |
Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
科目:高中化学 来源: 题型:
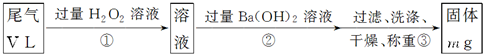
| 22.4m |
| 233V |
| 22.4m |
| 233V |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
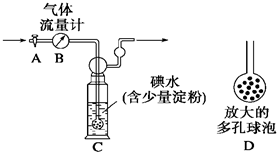
 硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
| 22.4m |
| 233V |
| 22.4m |
| 233V |
查看答案和解析>>
科目:高中化学 来源:2012届四川省南充高中高三上学期第二次月考化学试卷 题型:计算题
(8分)黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀至 2.12 L时测得其pH=0;将稀释后的溶液分为两等份,向其中一份溶液中滴加浓度为6. 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶
05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶 液的体积变化如下图所示:
液的体积变化如下图所示:
(1)请通过计算确定:m=________。
(2)X的摩尔质量为368 g/mol,则X的化学式为________________。
(3)将一定质量的Fe、Cu的混合物平均分成四等份,每份13.2 g,分别加入同浓度的稀硝酸 ,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
查看答案和解析>>
科目:高中化学 来源:2012届江苏省阜宁高中、大丰高中、栟茶高中高三第二次调研联考化学试卷 题型:填空题
(12分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g )+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵8 00℃时,C(s)+CO2(g)
00℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。(请写出必要的解题步骤)
②计算氧化物FemOn的化学式(m、n为正整数)(请写出必要的解题步骤)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com