
甲、乙两容器都发生反应2 A(g)+B(g) 3C(g),两容器温度和初始压强都相同。在甲恒容容器中充入2 mol A和1 mol B,达平衡后,C在平衡混合气中的体积分数为φ1、物质的量为n1;在乙恒压容器中充入1.4 mol A、0.7 mol B和0.6 mol C,达平衡后C在平衡混合气中的体积分数为φ2、物质的量为n2。下列说法中正确的是
3C(g),两容器温度和初始压强都相同。在甲恒容容器中充入2 mol A和1 mol B,达平衡后,C在平衡混合气中的体积分数为φ1、物质的量为n1;在乙恒压容器中充入1.4 mol A、0.7 mol B和0.6 mol C,达平衡后C在平衡混合气中的体积分数为φ2、物质的量为n2。下列说法中正确的是
A.φ1>φ2 B.n1>n2 C.n1=n2 D.φ1<φ2
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:2014秋贵州省遵义市高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列现象与电化学腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁心(几乎是纯铁)容易生锈
C.铁制器件附有铜质配件,在接触处易生锈
D.银质奖牌在空气中久置后表面变暗
查看答案和解析>>
科目:高中化学 来源:2014秋福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
以下实验操作正确的是
A.用量筒量取5.0 mL浓硫酸并直接在量筒中稀释
B.用嘴吹灭燃着的酒精灯火焰
C.称量NaOH固体时,将药品直接放在托盘上
D.给烧瓶里的液体加热时,垫上石棉网
查看答案和解析>>
科目:高中化学 来源:2014秋福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列物质所含分子数最少的是
A.标准状况下4.48L氧气
B.11g二氧化碳气体(CO2的摩尔质量是44g·mol-1)
C.0.5mol氨气
D.含NA个氢分子的氢气
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从表格中判断以下说法中不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++ SO42-
D.水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
向浓度为0.1 mol·L-1的K2CO3溶液中分别加入下列物质,能使C(CO32-)增大的是
A.H2O B.CO2 C.KHSO4固体 D.KOH固体
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:实验题
(13分)表示溶液浓度的方法通常有两种:溶液中溶质的质量分数(ω)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.00g·cm-3)的NaOH溶液配制成27.5g2%的NaOH溶液。
①计算:需______g10%(密度为1.00g·cm-3)的NaOH溶液,需加______mL水(密度为1.00g·cm-3)进行稀释。
②量取:用_______mL量筒(可供选择的量筒规格有:5mL、10mL、25mL、50mL,下同)量取10%的NaOH溶液,量取时视线要跟量筒内液体_______相切,然后倒入烧杯里,用______mL量筒量取蒸馏水注入烧杯里。
(2)把98%(密度为1.84g·cm-3)的浓硫酸稀释成3 mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸___________mL(保留一位小数)。
②配制操作可分解成如下几步,正确的操作顺序是:___________。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线
③如果上述C操作中把未冷却的稀硫酸注入容量瓶中,所配溶液的浓度将_________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中量取浓硫酸后量筒内滞留的浓硫酸用少量蒸馏水洗涤并将洗涤液转入E操作中的小烧杯中,所配溶液的浓度将_________;如果上述G操作中目光仰视,所配溶液的浓度将_________;如果上述D操作中目光俯视,所配溶液的浓度将_________。
(3)实验室用NaOH固体配制1mol/L的NaOH溶液和用98%(密度为1.84g·cm-3)的浓硫酸配制1mol/L的H2SO4溶液各100mL。
①配制1mol/L的NaOH溶液,在用托盘天平称取NaOH固体时,天平读数为_______(填代号,下同)。
A.4.0g B.小于4.0g C.大于4.0g
②配制1mol/L的 H2SO4溶液,在烧杯中稀释浓硫酸的正确操作是: 。
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
下列变化必须另加入还原剂才能实现的是
A.MnO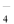 →MnO2 B.ClO3-→Cl-
→MnO2 B.ClO3-→Cl-
C.MnO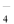 →Mn2+ D.FeO→Fe3O4
→Mn2+ D.FeO→Fe3O4
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
某溶液中Cl-、Br-、I-三者物质的量之比是1∶2∶3,通入一定量的C12,当反应完后比值为3∶2∶1,则反应的Cl2和原溶液中I-的物质的量之比是
A.1∶2 B.1∶3 C.1∶4 D.1∶6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com