
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为________________________________________________________________________
________________________________________________________________________,
反应消耗1 mol NaBH4时转移的电子数目为________________________________________________________________________。
科目:高中化学 来源: 题型:
根据框图回答下列问题(答题时,方程式中的M、E用所对应的元素符号表示):
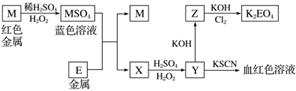
(1)写出M溶于稀硫酸和H2O2混合液的化学方程式________________________。
(2)某同学取X的溶液,酸化后加入KI淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式________________________、________________________。
(3)写出Cl2将Z氧化为K2EO4的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
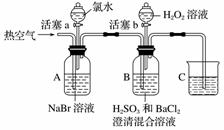
实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,滴加氯水, 关闭活塞a | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是________________________________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是________________________________________________________________________。
(3)装置C的作用是__________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是________________________________________________________________________。
(5)由上述实验得出的结论是________________________________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是________________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
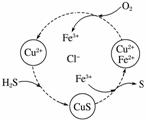
(1)在图示的转化中,化合价不变的元素是________。
(2)反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为______。
(3)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是4Ag+2H2S+O2===2X+2H2O,下列说法正确的是( )
A.X的化学式为AgS
B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂
D.每生成1 mol X,反应转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.MnO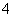 是氧化剂,Fe3+是还原产物
是氧化剂,Fe3+是还原产物
B.Fe2+的还原性强于Mn2+
C.取反应后的溶液加入KSCN溶液,可观察到溶液变成血红色
D.生成1 mol水时,转移2.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
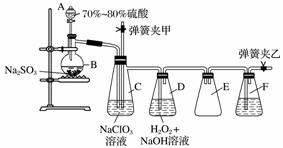
装置C中发生反应:2NaClO3+SO2===2ClO2+Na2SO4(Ⅰ)
装置D中发生反应:2ClO2+H2O2+2NaOH===2NaClO2+2H2O+O2(Ⅱ)
(1)仪器组装完毕,关闭两个弹簧夹,打开A中活塞,向A中注入水可检验装置气密性,装置气密性良好的现象是________________________。实验开始时,打开A的活塞,两个弹簧夹的开关操作是__________________,F中盛有的液体为________。
(2)装置B中进行的是用硫酸与亚硫酸钠制备二氧化硫的反应,该处使用的是70%~80%的硫酸,而不是98%的浓硫酸或极稀的硫酸,原因是____________。
(3)装置C的作用是________________,装置E的作用是________________。
(4)在碱性溶液中NaClO2比较稳定,所以装置D中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是________。
a.稀盐酸 b.品红溶液 c.石蕊溶液 d.酚酞溶液
(5)一次实验制备中,通过检验发现制备的NaClO2中含有NaOH、Na2SO3,出现这些杂质的可能原因是__________________。检验产物中含有Na2SO3杂质的实验操作和现象是________________________________________________________________________。
(供选择的试剂有:Ba(OH)2溶液、H2O2溶液、AgNO3溶液、品红溶液、H2SO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。
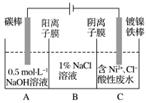
下列说法不正确的是( )
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH--4e-===O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com