
下列有关化学用语表示正确的是
A.CaH2的电子式:[H:]-Ca2+[:H]-
B.Cl-的结构示意图: 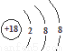
C.质子数为92、中子数为146的U原子: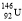
D.CH2F2的电子式: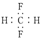
科目:高中化学 来源:2015-2016学年吉林省扶余市高一上学期期中测试化学试卷(解析版) 题型:填空题
若在相同温度压强下,对于氨气(NH3)和硫化氢(H2S)气体:
(1)等质量的氨和硫化氢气体的体积比为 ;
(2)等体积的氨气和硫化氢气体的质量比为 ;
(3)若二者氢原子数相等,则它们的体积比为 ;
(4)硫化氢的密度是氨气的 倍。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省宜宾市高二上学期期中测试化学试卷(解析版) 题型:选择题
把6 mol A气体和5 mol B气体混合放入4 L密闭容器中,在一定条件下发生反应:
3A(g)+B(g) 2C(g)+xD(g)。经5 min达到平衡,此时生成2 mol C,测定知D的平均反应速率为0.1 mol/(L·min),下列说法中错误的是
2C(g)+xD(g)。经5 min达到平衡,此时生成2 mol C,测定知D的平均反应速率为0.1 mol/(L·min),下列说法中错误的是
A.x=2
B.B的转化率为20%
C.平衡时A的浓度为0.75 mol/L
D.恒温达到平衡时容器内压强为开始时的85%
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中测试理综化学试卷(解析版) 题型:填空题
有X、Y、Z、R四种短周期主族元素,Y、Z、R同周期。相关信息如下:
相关信息 | |
X | 单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
Y | 含Y元素的物质焰色反应为黄色 |
Z | 同周期元素中原子半径最小 |
R | R元素原子的最外层电子数是K层电子数的3倍 |
I.(1)Z元素在周期表的位置是 ,Y、Z、R简单离子的半径从大到小的顺序是 (用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水可形成一种常见的漂白性物质。则甲的结构式为 ;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为 ,写出乙溶液在空气中变质生成Y2R2的化学方程式 。
II.元素X与氢可形成多种化合物,如丙、丁、戊。
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸。8.6 g丙爆炸分解生成H2和6.72 L(标况下)X2。写出其爆炸的化学方程式 ;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76 g·L-1,则物质丁的化学式为 ;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式 ,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法) 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.NH4HSO4溶液中加入少量NaOH稀溶液:NH4+ + OH- = NH3·H2O
B.Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO- + SO2 + H2O=HClO + HSO3-
C.酸性高锰酸钾溶液中滴入少量过氧化氢:2MnO4- +7H2O2+6H+ =2Mn2+ + 6O2↑ + 10H2O
D.为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3—+H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016届湖北省老河口市高三上学期期中测试化学试卷(解析版) 题型:选择题
将足量铁粉投入一定浓度的氯化铁和氯化铜的混合溶液中,充分反应后,溶液中剩余固体的质量与加人铁粉的质量相同,则原溶液中氯化铁和氯化铜的浓度之比为
A.2:7 B.3;4 C.4:7 D.2:3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上学期第一次月考化学试卷(解析版) 题型:填空题
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)反应过程中测定的部分数据见下表
CO2(g)+H2(g)反应过程中测定的部分数据见下表
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)若保持其他条件不变,起始时向容器中充入0.60molCO(g)和0.30 molH2O(g),到达平衡时,n(CO2)= mol。
(3)若保持其他条件不变,向平衡体系中再通入H2O(g) 、CO2(g)各0.10mol,达到新平衡时CO2(g)的体积分数为 。
(4)若温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热” )。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省无锡市四校高二上学期期中测试化学试卷(解析版) 题型:实验题
溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:
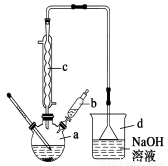
步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中,充分反应。
步骤2:向a中加入10 mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗涤,分液得粗溴苯。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
(1)步骤1仪器a中发生的主要反应是
(2)仪器d的作用是
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是
(4)仪器c的作用是冷凝回流,回流的主要物质有 (填化学式)
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(5)步骤4得到的粗产品中还含有杂质苯,已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一上学期期中测试化学试卷(解析版) 题型:选择题
设NA 表示阿伏加德罗常数,数值约为6.02×1023。下列说法正确的是
A.1 L 0.1mol·L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol
B.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数
C.在25℃,1.01×105 Pa时,11.2 L氧气所含的氧原子数目为6.02×1023
D.标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com