
把一定量的Na2O2和NaHCO3的混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标况);再将此气体通入另一份混合物中,恰好完全反应后,得到O2 2.016L(标况),则加入稀盐酸的物质的量浓度是( )
|
| A. | 3.4mol/L | B. | 0.2mol/L | C. | 1.8mol/L | D. | 3.6mol/L |
| 有关混合物反应的计算. | |
| 分析: | 第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2↑、②NaHCO3+HCl=NaCl+H2O+CO2↑,生成气体为O2与CO2; 将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据气体物质的量差量利用差量法计算参加反应的二氧化碳的物质的量,从而计算出第一份中生成二氧化碳、氧气的物质的量,再根据反应方程式计算出反应消耗的HCl总的物质的量,最后根据c=计算出盐酸的浓度. |
| 解答: | 解:标况下2.24L混合气体的物质的量为: 2.016LO2的物质的量为:n(O2)= 2Na2O2+2CO2=2Na2CO3+O2 气体物质的量减小△n 2 2 1 n(CO2) 0.1mol﹣0.09mol=0.01mol 所以:n(CO2)= 由于恰好完全反应,则第一份生成的CO2与混合物中含有的过氧化钠反应,第一份生成CO2的为0.02mol,生成的O2为:0.1mol﹣0.02mol=0.08mol,则: 2Na2O2+4HCl=4NaCl+2H2O+O2↑ 0.32mol 0.08mol NaHCO3+HCl=NaCl+H2O+CO2↑ 0.02mol 0.02mol 所以消耗的HCl的物质的量为:0.32mol+0.02mol=0.34mol,其物质的量浓度为: 故选A. |
| 点评: | 本题考查混合物反应的计算,题目难度中等,注意明确差量法在化学计算中的应用,正确分析题干信息并明确反应原理为解答本题的关键,试题培养了学生的分析、理解能力及化学计算能力. |


科目:高中化学 来源: 题型:
(1)分析下列物质的物理性质,判断其晶体类型。
A.碳化铝,黄色晶体,熔点2200 ℃,熔融态不导电________;
B.溴化铝,无色晶体,熔点98 ℃,熔融态不导电________;
C.五氟化钒,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中________;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电________。
(2)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
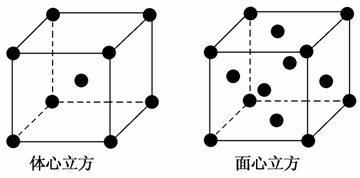
(3)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如上图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 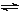 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
|
| A. | 1L 1mol•L﹣1的CH3COOH溶液中含有NA个氢离子 |
|
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L﹣1 |
|
| C. | 0.1mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15NA |
|
| D. | VL CO和NO的混合气体中含有的氧原子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些离子的检验及结论一定正确的是( )
|
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣ |
|
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ |
|
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
|
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
向27.2gCuO、Cu的混合物中加入某浓度的稀HNO3500mL,固体完全溶解后,生成NO和Cu(NO3)2.在所得溶液中加入1mol/L 的NaOH溶液1L使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g.则:
(1)Cu与Cu2O 的物质的量之比为 .
(2)HNO3的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某高聚物可表示为
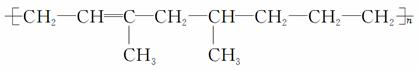
下列有关叙述错误的是( )
A.该高聚物是通过加聚反应生成的
B.合成该高聚物的单体有3种
C.该物质能被酸性KMnO4溶液氧化
D.1 mol该物质与1 mol H2加成,生成不含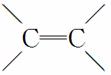 的物质
的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
天然橡胶的主要成分是聚异戊二烯
(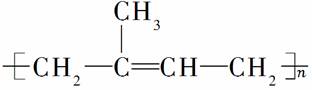 ),许多合成橡胶也有类似的结构。下列试剂与橡胶较长时间接触不会发生反应的是( )
),许多合成橡胶也有类似的结构。下列试剂与橡胶较长时间接触不会发生反应的是( )
A.酸性高锰酸钾溶液
B.溴水
C.浓硝酸
D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
质量均为100 g的铜作为电极电解硝酸银溶液,电解一段时间后,两电极质量相差28 g,此时阳极质量为( )
A.121.6 g B.88.2 g
C.89.6 g D.93.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com