
| A. | ②③④⑤⑥⑧ | B. | ①②③④⑤⑧ | C. | ②③④⑤⑧ | D. | 全部 |
分析 ①根据Cl2能与水反应生成次氯酸;
②Si是半导体材料,二氧化硅是光导纤维的成份;
③SO2可用于工业上杀菌消毒;
④Si是半导体材料,二氧化硅是光导纤维的成份;
⑤碘是预防甲状腺肿大的主要元素;
⑥淀粉遇碘变蓝色;
⑦与二氧化碳、水反应生成次氯酸,次氯酸具有强氧化性,可用于漂白纺织物;
⑧Al2O3是高熔点是耐高温材料.
解答 解:①Cl2能与水反应生成次氯酸,次氯酸可作消毒剂,用于杀菌消毒,故①正确;
②Si是半导体材料,二氧化硅是光导纤维的成份,所以Si是半导体材料,故②正确;
③SO2可用于工业上杀菌消毒,所以二氧化硫可以杀菌消毒,故③正确;
④Si是半导体材料,二氧化硅是光导纤维的成份,SiO2是光导纤维,故④正确;
⑤碘是预防甲状腺肿大的主要元素,故⑤正确;
⑥淀粉遇碘变蓝色,可用来检验碘单质,故⑥正确;
⑥Ca(ClO)2-与二氧化碳、水反应生成次氯酸,次氯酸具有强氧化性,可用于漂白纺织物,故⑥正确;
⑧Al2O3是高熔点是耐高温材料,故⑧正确;
故选:D.
点评 本题考查常见物质的性质及应用,题目难度不大,注意常见相关基础知识的积累,性质决定用途.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 石英 SiO2 酸 | B. | 纯碱 Na2CO3 碱 | ||
| C. | 绿矾 FeSO4•7H2O 盐 | D. | 磁铁矿 Fe2O3 金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{5}{3}$X<P<$\frac{17}{9}$X | B. | P=X+$\frac{V•C}{12.5}$ | C. | Y=X+V•C | D. | C=$\frac{1000B}{11.2V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当2v(X2)正=v(Z)逆时,反应达到平衡 | |
| B. | 当容器压强不随时间变化时,反应达到平衡 | |
| C. | 当反应达到平衡时,X2的物质的量小于1mol | |
| D. | 当反应达到平衡时,容器里X2、Y2、Z在容器中共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 黑火药的使用 | D. | 打磨磁石制指南针 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用微生物发酵技术,将植物秸杆、动物粪便等制成沼气 | |
| B. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| C. | 氢氧燃料电池、硅太阳能电池中都利用了原电池原理 | |
| D. | 采用光触媒技术将汽车尾气中的NO和CO转化为无毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z | 箭头上为反应条件或试剂 | 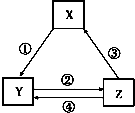 |
| A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
| B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2、再通过量NH3 | |
| C | SiO2 | Na2SiO3 | H2SiO3 | ③加热 | |
| D | NaAlO2 | Al(OH)3 | Al2O3 | ④加H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:W>X | B. | Y的最高化合价为+7 | ||
| C. | 原子半径:r(W)<r(X)<r(Y)<r(Z) | D. | W、X、能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com