
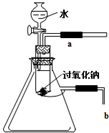
 用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.分析 (1)燃烧的条件是①物质具有可燃性,②可燃物与氧气接触,③温度达到可燃物的着火点,根据燃料燃烧的条件分析;
(2)①氧气具有能使带火星的木条复燃的性质;
②气体具有热胀冷缩的性质,该反应放出的热量能使集气瓶内空气的压强增大,据此分析问题.
解答 解:( 1)脱脂棉剧烈燃烧说明具备燃烧的条件,试管内空气较少,若剧烈燃烧应该有大量氧气,只有该反应是放热反应才能使燃料温度达到着火点,根据题意知该反应有氧气生成且放热,故答案为:有热量放出;
(2)①氧气具有使带火星的木条复燃的性质,所以可用带火星的木条靠近a处,如果木条复燃,则有氧气生成,反之无氧气生成,
故答案为:用带火星的木条靠近a口处;带火星的木条复燃;
②气体具有热胀冷缩的性质,如果该反应放热,放出的热量能使集气瓶内空气的压强增大;如果b导管插入盛水的小烧杯中,有气泡冒出,证明此反应放热,
故答案为:将导管b置于水槽中.再打开分液漏斗的开关,发现b处有气泡放出.
点评 本题考查了过氧化钠和水反应的实验,难度不大,解答时要从实验现象方面进行分析、判断,从而得出正确的结论.


科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物都是金属氧化物 | |
| B. | 凡是酸性氧化物都能和水反应生成相应的酸 | |
| C. | 单质含有一种元素,有一种元素形成的物质就是单质 | |
| D. | 凡在水中电离出H+的物质就是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
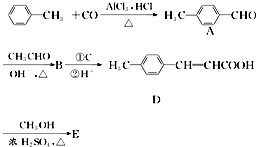
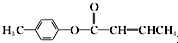 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为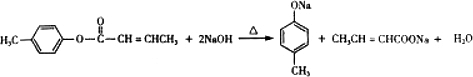 .
.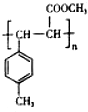 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | AlCl3溶液中滴加过量的氨水:Al3++4 NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | 铜与浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 向小苏打溶液中滴入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、烧碱、氯酸钾、过氧化钠分别属于酸、碱、盐、碱性氧化物 | |
| B. | PM2.5指大气中直径接近于2.5×10-6 m的颗粒物,PM2.5在空气中形成胶体 | |
| C. | 氯气的水溶液能导电,因此氯气属于电解质 | |
| D. | 反应8NH3+3Cl2═N2+6NH4Cl中,氧化剂与还原剂物质的量之比是3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中混有的少量HCl气体,可将其通过饱和Na2CO3溶液 | |
| B. | 铁粉中混有少量铝粉,可加入NaOH溶液,充分反应后过滤除去 | |
| C. | 将某化合物进行焰色实验,观察焰色为黄色,说明不含K+ | |
| D. | 向某溶液中加入BaCl2溶液,产生大量白色沉淀,说明溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 (1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
(1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com