
某盛有液态水和少量
NO2气体的定容容器中,反应3NO2(g)+H2O(l)(1)若向此平衡体系中通入少量Ne(g),则平衡________(填“向右”“向左”或“不”)移动,原因是________.
答案:不原平衡时的反应物和生成物的浓度没有变化,正反应和逆反应的速率仍然相等
正确解法:由物理学知识可知,容器中的压强实际上是气体分子对容器单位面积上的压力,容器内气体分子浓度越大,容器内的压强越大.这就是说,某一平衡体系内压强的变化,并不是通过体积变化来实现的,而是通过浓度的变化而引起的.因此,讨论压强对平衡移动的影响时,最终还应回到浓度上来研究.通入少量
Ne(g)虽能使容器内压强增大,但反应物和生成物的浓度并没有变化,浓度不变,原平衡的正反应和逆反应的速率仍然相等,所以,平衡不移动.点评:平衡是否发生移动的核心问题是正逆反应速率是否相等.不论是温度、浓度、还是压强的变化,最终都要归结到正逆反应速率上来讨论,当
v正=v逆时,平衡不移动;当v正>v逆时,平衡向正反应方向移动;当v正<v逆时,平衡向逆反应方向移动.定容容器的平衡体系中,通入惰性气体,虽然压强增大,但由于容器体积不变,反应物和生成物的浓度不变,所以正逆反应速率不变,平衡不移动.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
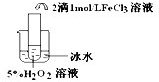
| 实验目的 | 探究温度对H2O2分解反应速率的影响 探究温度对H2O2分解反应速率的影响 | ||||||||||
实验 |
 |
 |
 | ||||||||
| 实验结论 | 结论: 温度越高,反应速率越快 温度越高,反应速率越快 FeCl3在实验中的作用为: 催化剂 催化剂 | ||||||||||
| 反应方程式 | 2H2O2
2H2O2
| ||||||||||
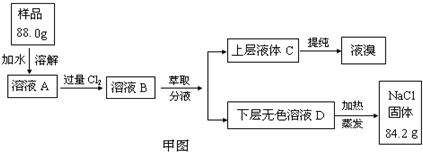
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4,振荡、静置 |
(1)溶液分层,上层几 乎无色,下层为橙色. (2) 溶液分层,上层几乎无色,下层为紫(红)色 溶液分层,上层几乎无色,下层为紫(红)色 |
(1) Cl2+2Br-=Br2+2Cl- Cl2+2Br-=Br2+2Cl- (2) Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- |
| 2.将少量溴水加入盛有NaI溶液的试管中, 振荡后加入少量CCl4,振荡、静置 |
/ | (3) Br2+2I-=I2+2Br- Br2+2I-=I2+2Br- |
| 实验结论并从原子结构上解释原因 | 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 | |

查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修6 1.2 植物中某些成分的提取练习卷(解析版) 题型:填空题
某实验小组利用纸上层析法分离甲基橙和酚酞,所选的实验用品如下:酚酞、乙醇、浓氨水、饱和Na2CO3溶液、培养皿、滴管、烧杯、量筒、毛细管、小喷壶。步骤:
①在一张圆形滤纸的中心扎一小孔,用少量滤纸捻成细芯,插入圆形滤纸中央。
②在距圆形滤纸中心约1 cm的圆圈上选择三个点,分别用毛细管将甲基橙和酚酞的混合液在该三点处点样,每个点样的直径约0.5 cm。
③把0.1 g甲基橙和0.1 g酚酞溶解在10 mL 60%的乙醇溶液里:取10 mL乙醇和4 mL浓氨水充分混合。
④待黄环半径扩散到滤纸半径的二分之一时,取下滤纸,拔除细纸芯。待滤纸稍干后,喷上饱和的Na2CO3溶液,观察现象。
⑤将滤纸覆盖在盛有乙醇和氨水混合液的培养皿上,使滤纸芯与混合液接触,放置一段时间,点样会逐渐扩散,形成黄环。
根据实验回答下列问题:
(1)该实验小组所选取的实验用品中,缺少的试剂或用品为:________________。
(2)该实验的正确操作顺序为________。
(3)在实验过程中,滤纸起到________的作用。中间的滤纸芯起到的作用是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
探究实验: 检验 Fe2+的方法
实验步骤:1、在两支试管中分别加入10mlFeCl3和10mlFeCl2溶液,然后各滴入几滴KSCN溶液,观察现象。
2、在盛有FeCl2和KSCN溶液的试管中滴入几滴新配置的氯水,观察现象。
(1)实验现象:步骤1中盛10mlFeCl2溶液的试管中溶液_______________________
步骤2中溶液_______________________________________
(2)步骤2中涉及的氧化还原反应的离子方程式为:________________________________________________
(3)欲证明某溶液中不含Fe3+可能含有Fe2+,下列实验操作的最佳顺序为( )
①加少量氯水 ② 加少量KMnO4溶液 ③ 加少量KSCN
A、①③ B、②③ C、③① D、①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com