
| A. | 增大反应物的浓度,平衡常数K增大 | B. | 加大体系压强,平衡常数K增大 | ||
| C. | 加入负催化剂,平衡常数K减小 | D. | 升高温度,平衡常数K发生变化 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
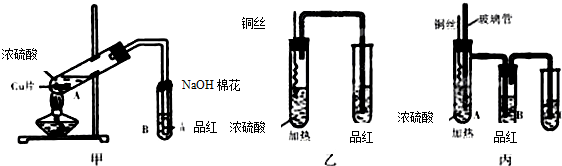
 某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.
某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正逆反应速率都增大 | |
| B. | 平衡不移动 | |
| C. | 再次平衡时c(D) 不变 | |
| D. | C的体积分数不再变化说明再次达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
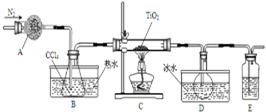 实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| B. | 化学反应速率为“0.8mol/(L•min)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L | |
| C. | 化学反应达到平衡状态,反应停止 | |
| D. | 化学反应速率是定量描述化学反应快慢的物理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学方程式 | K(t1) | K(t2) | |
| ① | Br2 (g)+H2(g)?2HBr(g) | 5.6×107 | 9.3×106 |
| ② | I2 (g)+H2 (g)?2HI(g) | 43 | 34 |
| A. | ①和②均是放热反应 | |
| B. | 相同条件下,平衡体系中HX所占的比例:①>② | |
| C. | 其他条件不变时,增大压强可提高X2的平衡转化率 | |
| D. | 其他条件不变时,升高温度可加快HX的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H+(aq)+OH- (aq)=H2O(l)△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)=H2O(l)△H=-44.0kJ•mol-1可知是放热反应; | |
| C. | 由SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 氢气的燃烧热(△H)为-285.5kJ/mo1,则水电解的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5KJ/mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | Si-O | O=O | Si-Si |
| 键能kJ•mol-1 | 460 | 498.8 | X |
| A. | 423.3 | B. | 352 | C. | 920 | D. | 176 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com