
| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 二氧化碳电子式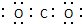 | |
| D. | 第三周期元素形成的简单离子中,半径最小的是Al3+ |
分析 A、氟化氢分子与分子间存在氢键,所以第VⅡA族元素形成的氢化物中沸点最高的是氟化氢;
B、分子的稳定性是化学性质,与氢键无关;
C、二氧化碳分子中含有两个碳氧双键,碳原子最外层为8个电子;
D、离子电子层数越多,其半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:A、氟化氢分子与分子间存在氢键,所以第VⅡA族元素形成的氢化物中沸点最高的是氟化氢,而不是碘化氢,故A错误;
B、分子的稳定性是化学性质,与氧的非金属性有关,故B错误;
C、二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ,故C错误;
,故C错误;
D、离子电子层数越多,其半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小,第三周期移动离子半径先减小后增大,离子半径最小的是Al3+,故D错误;
故选D.
点评 本题考查元素周期律,侧重考查学生分析判断能力,知道同一周期、同一主族元素原子结构及其性质递变规律即可解答,易错选项是D,注意离子半径大小比较方法.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:选择题
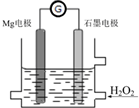 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 镁电极是该电池的负极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-═Mg2+ | |
| D. | 电池工作时,电子从石墨电极经导线流向Mg电极,溶液中阳离子流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲一定是烷烃 | |
| B. | 乙的物质的量为0.05mol | |
| C. | 符合条件的乙的可能结构有3种(包含顺反异构) | |
| D. | 甲的质量为2.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应类型:加聚反应(或聚合反应)
,反应类型:加聚反应(或聚合反应) 反应类型:取代反应
反应类型:取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定实验中,如用于装标准液的滴定管洗净、干燥后,未经润洗,测定结果偏高 | |
| B. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| C. | 纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 | |
| D. | 检验新鲜鸡血中的铁元素时,可在鸡血中加入稀硝酸并加热搅拌蒸干得到固体粉末,取少许粉末加入亚铁氰化钾稀溶液,可得蓝色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶液的浓度等于氢氧化钠溶液 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | c(NH3•H2O)+c(NH4+)=0.01 mol•L-1 | |
| D. | 往等体积的两溶液中加入盐酸恰好中和,消耗盐酸多的溶液pH值小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
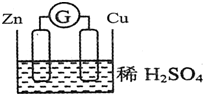 请观察如图装置,回答下列问题:
请观察如图装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
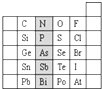 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.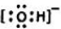 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com