
【题目】以甲烷为原料合成甲醇的反应如下:
反应I:CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g) △H1= +247 kJ/mol
2CO(g) + 2H2(g) △H1= +247 kJ/mol
反应II:CO(g) + 2H2(g)![]() CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
已知: T1℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是
A. 反应I中,使用催化剂可以减小△H1,提高反应速率
B. 反应II 中,加热或加压均可提高原料气的平衡转化率
C. 由上述数据可判断反应II 的温度: T1> T2
D. CO(g)+CH3OH(g)![]() CH4(g) +CO2(g) △H= +157 kJ/mol
CH4(g) +CO2(g) △H= +157 kJ/mol
【答案】C
【解析】A、反应热只与始态和终态有关,使用催化剂降低活化能,化学反应速率加快,但△H1不变,故A错误;B、正反应是放热反应,加热,平衡向逆反应方向移动,原料气的转化率降低,反应前气体系数之和大于反应后气体系数之和,增大压强,平衡向正反应方向移动,原料气的转化率增大,故B错误;C、T2℃时的化学平衡常数K=![]() =2<100,反应II的正反应为放热反应,温度升高,化学平衡常数减小,即T1℃>T2℃,故C正确;D、反应I+反应II得到CH4(g)+CO2(g)
=2<100,反应II的正反应为放热反应,温度升高,化学平衡常数减小,即T1℃>T2℃,故C正确;D、反应I+反应II得到CH4(g)+CO2(g)![]() CO(g)+CH3OH(g) △H=(274-90)kJ·mol-1=+184kJ·mol-1, CO(g)+CH3OH(g) CH4(g) +CO2(g) △H=-184kJ·mol-1,故D错误。
CO(g)+CH3OH(g) △H=(274-90)kJ·mol-1=+184kJ·mol-1, CO(g)+CH3OH(g) CH4(g) +CO2(g) △H=-184kJ·mol-1,故D错误。


科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或溶液)的转化关系,已知单质B2、C2、D2、E2在常温常压下都是气体,化合物G的焰色反应为黄色;化合物I、J、K通常状况下呈气态。下列说法正确的是

A. B氢化物的沸点高于其同主族其它元素氢化物的沸点
B. 原子半径大小:A>C>B>E>D
C. F中既含有离子键又含有极性共价键
D. G中的阴离子能抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为_____________________________________________________。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g) ![]() CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
时间/min 物质的浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
①该反应第一次达平衡时的平衡常数K=_______________。
②3min时改变的反应条件是__________________(只填一种条件的改变即可)。
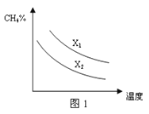
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1 ______X2(填“=”、“>”或“<”)。
Ⅱ.(4)已知常温下HCOOH的电离常数为![]() ,则HCOO—的水解反应HCOO- + H2O
,则HCOO—的水解反应HCOO- + H2O ![]() HCOOH + OH-的平衡常数K h =__________________。
HCOOH + OH-的平衡常数K h =__________________。
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是______________________________。
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是( )mol/L
A. 0.15 B. 0.225 C. 0.35 D. 0.45
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国利用合成气直接制烯烃获重大突破,其原理是( )
反应①:C(s)+1/2O2(g)=CO(g) ΔH1
反应②:C(s)+H2O(g)=CO(g)+H2(g) ΔH2
反应③:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.1 kJ·mol-1
反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4,能量变化如下图所示

反应⑤:3CH3OH(g)=CH3CH=CH2(g)+3H2O(g) ΔH5=-31.0 kJ·mol-1
下列说法正确的是( )
A. 反应③使用催化剂,ΔH3减小
B. 反应④中正反应的活化能大于逆反应的活化能
C. ΔH1-ΔH2<0
D. 3CO(g)+6H2(g)→CH3CH===CH2(g)+3H2O(g) ΔH=-121.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可制取有广泛用途的Na2FeO4:Fe+2H2O+ 2NaOH![]() Na2FeO4+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeOH42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。下列说法不正确的是
Na2FeO4+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeOH42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。下列说法不正确的是

A. a是电源的正极
B. 电解一段时间后,c(OH-)降低的区域在阴极室
C. 电解过程中,阳极发生的电极方程式为Fe+8OH--6e-==FeO42-+4H2O
D. 如图2,N点c(Na2FeO4)低于最高值的原因是氢氧化钠溶液浓度过高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与颜色有关的描述中不正确的是
A. 铜在氯气中燃烧产生棕黄色烟
B. FeCl3溶液中加入KSCN溶液产生血红色沉淀
C. 将Cl2通人石蕊溶液,石蕊溶液先变红后褪色
D. 氢气在氯气中燃烧,产生苍白色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在强酸性溶液中能大量共存的是
A.Na+、K+、Ca2+、HCO3- B.NO3-、Cl-、Na+、Ag+
C.Cu2+、Fe2+、SO42-、Cl- D.Mg2+、Na+、Cl-、CH3COO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com