
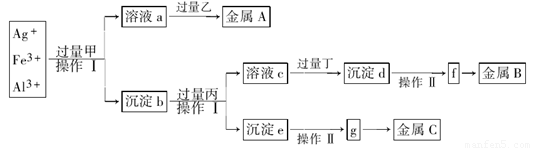
从含有Ag+、Fe3+和Al3+的溶液中,按下图所示方法分离提取金属单质
 ?
?
已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取。对该实验过程的分析正确的是
A.丙是NaOH,丁是稀H2SO4
B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来
C.操作I是过滤和洗涤沉淀。洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次
D.g是氧化物,金属c采用电解法获得
B
【解析】
试题分析:向某溶液中加入碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中的一种溶液,能产生金属单质,则加入的物质应该有还原性,乙只能为葡萄糖溶液。溶液a中应该含有Ag(NH3)2+.所以甲溶液为NH3 .它是由(NH4)2CO3与NaOH共热制取的。反应的方程式为:(NH4)2CO3+2NaOH Na2CO3+ 2NH3↑ + 2H2O。沉淀b为Fe(OH)3和Al(OH)3. 由于Al(OH)3是两性物质,能够被过量的强碱溶液溶解,而Fe(OH)3不能与强碱发生反应,可以通过过滤分离开。因此丙是NaOH溶液。溶液c为NaAlO2,沉淀e为Fe(OH)3。向NaAlO2溶液中加入过量的丁产生沉淀d,因为Al(OH)3两性,只能与强酸、强碱反应,而与弱酸、弱碱吧反应,所以丁应该是CO2;沉淀d是Al(OH)3。丁是由(NH4)2CO3与H2SO4反应制取的。反应的方程式为:(NH4)2CO3+ H2SO4= (NH4)2SO4+ CO2↑ + H2O。将沉淀d过滤出来,洗涤、干燥,然后加热发生分解反应:2Al(OH)3
Na2CO3+ 2NH3↑ + 2H2O。沉淀b为Fe(OH)3和Al(OH)3. 由于Al(OH)3是两性物质,能够被过量的强碱溶液溶解,而Fe(OH)3不能与强碱发生反应,可以通过过滤分离开。因此丙是NaOH溶液。溶液c为NaAlO2,沉淀e为Fe(OH)3。向NaAlO2溶液中加入过量的丁产生沉淀d,因为Al(OH)3两性,只能与强酸、强碱反应,而与弱酸、弱碱吧反应,所以丁应该是CO2;沉淀d是Al(OH)3。丁是由(NH4)2CO3与H2SO4反应制取的。反应的方程式为:(NH4)2CO3+ H2SO4= (NH4)2SO4+ CO2↑ + H2O。将沉淀d过滤出来,洗涤、干燥,然后加热发生分解反应:2Al(OH)3 Al2O3+ 3H2O.得到固体f: Al2O3.再电解Al2O3即得到金属B:Al. 2Al2O3
Al2O3+ 3H2O.得到固体f: Al2O3.再电解Al2O3即得到金属B:Al. 2Al2O3 4Al+3O2↑.将沉淀e Fe(OH)3过滤出来,洗涤、干燥,然后加热发生分解反应:2Fe(OH)3
4Al+3O2↑.将沉淀e Fe(OH)3过滤出来,洗涤、干燥,然后加热发生分解反应:2Fe(OH)3 Fe2O3+ 3H2O.得到固体g: Al2O3.再用CO还原Al2O3即得到金属C:Fe。3CO+Al2O3
Fe2O3+ 3H2O.得到固体g: Al2O3.再用CO还原Al2O3即得到金属C:Fe。3CO+Al2O3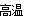 2Fe+ 3CO2.通过上述分析可知正确选项为B.
2Fe+ 3CO2.通过上述分析可知正确选项为B.
考点:考查从溶液中分离提取金属单质的实验操作及方法的知识。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:

| A、丙是NaOH,丁是稀H2SO4 | B、乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来 | C、操作I是过滤和洗涤沉淀.洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次 | D、g是氧化物,金属c采用电解法获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:
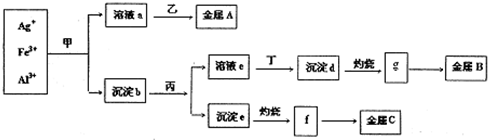
| A、金属A、B、C分别为Ag、Fe、Al | B、g、f都为氧化物,工业上均采用电解g与f获得对应金属单质 | C、沉淀b为混合物,主要成分为沉淀d和沉淀e | D、甲是氢氧化钠,丁为稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
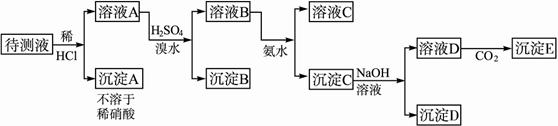 根据实验结果:
根据实验结果: (1)判定待测液中有无Ba2+、Ca2+,并写出理由。_________________________。
(2)写出沉淀D的分子式:_________________________。
(3)写出从溶液D生成沉淀E的反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
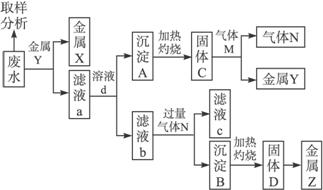
回答下列问题:
(1)固体C的化学式为____________,滤液b中通入过量气体N发生反应的离子方程式为____________________________________,固体D转化为金属Z的化学方程式为________________________。
(2)取样分析废水中Ag+、Fe3+、Al3+的含量,目的是____________。
a.控制溶液中Ag+、Fe3+、Al3+含量比 b.确定下一步加入金属Y的量
c.确定滤液a中加入溶液d的量 d.确定沉淀A转化为固体C所需的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com