
| A. | 铁做还原剂 | B. | Fe2O3做氧化剂 | ||
| C. | 铁元素被还原 | D. | 铁元素化合价升高 |
科目:高中化学 来源: 题型:选择题
| A. | FeS04•7H20-绿矾 | B. | Na2O2-火碱 | C. | BaC03-重晶石 | D. | C6Hl206-庶糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常作为气体的干燥剂 | B. | 常温下不能与铁发生反应 | ||
| C. | 滴在蔗糖上,蔗糖会变黑 | D. | 工业上主要采用接触法制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的摩尔质量是64 g | |
| B. | 标准状况下18 g水的体积是22.4 L | |
| C. | 在标准状况下,20 mL NH3 与60 mL O2所含的分子数比为1:3 | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋可以作为防腐剂和调味剂 | B. | 味精可作调味剂 | ||
| C. | 甲醛是一种很好的食品防腐剂 | D. | 苯甲酸钠可用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn | B. | Fe | C. | Al | D. | Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 等质量的硫蒸气和硫磺固体分别完全燃烧,后者放出的热量多 | |
| C. | 相同体积浓度均为0.1 mol/L 盐酸和醋酸溶液分别与足量的NaOH稀溶液反应,前者放出热量多 | |
| D. | 氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | Na+、K+、Cl?、SO42- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Fe2+、K+、NO3-、Cl? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| AlT/(mol•L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
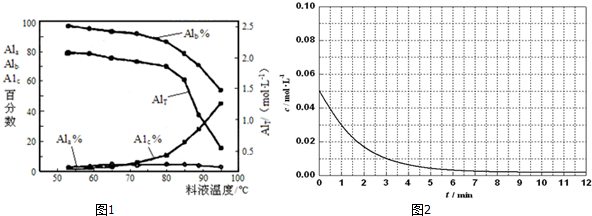
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com