
 .
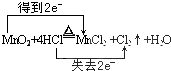
.分析 (1)在MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,1mol二氧化锰反应转移2mole-,据此用双线桥表示氧化还原反应电子转移;
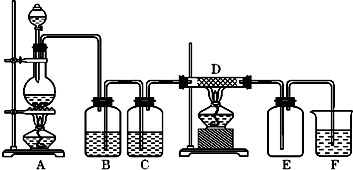
(2)B处为气体的净化装置,为洗气瓶,应长进短出;
(3)依据浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,据此选择饱和食盐水除去氯化氢;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水.
解答 解:(1)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,氧化剂为MnO2,1mol二氧化锰反应转移2mole-,用双线桥法表示反应中电子转移的数目为: ;
;
故答案为: ;
;
(2)B处为气体的净化装置,为洗气瓶,应长进短出;
故选:B;
(3)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,据此选择饱和食盐水除去氯化氢,所以B中盛放的饱和食盐水;
故答案为:饱和食盐水;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气的制备及性质检验,明确氯气制备原理和各装置作用是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL 1 mol/L的HNO3溶液 | B. | 1 L 0.5 mol/L的Fe(NO3)3溶液 | ||
| C. | 100 mL 0.5 mol/L的Mg(NO3)2溶液 | D. | 300 mL 1 mol/L的Mg(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2-的离子半径大于Y+的离子半径 | |
| B. | H2Z的沸点高于H2X | |
| C. | Z的简单气态氢化物稳定性比W的强 | |
| D. | Y2X2和Y2Z的晶体类型和化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备干燥的NH3:加热浓氨水,将生成的气体通过盛有浓硫酸的洗气瓶 | |
| B. | 提纯含有少量HCl的CO2:将混合气体依次通过盛有饱和碳酸钠溶液、浓硫酸的洗气瓶 | |
| C. | 检验食盐中是否含有碘酸钾:取少量的食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 | |
| D. | 探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的烧瓶,先后置于冷水和热水中,观察烧瓶中气体颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3→NaHCO3 | B. | Fe→FeCl2 | C. | NaCl→Na | D. | Al2O3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com