
【题目】研究化学反应常用188O作为示踪原子,该原子的质量数是( )
A.18
B.8
C.10
D.16
科目:高中化学 来源: 题型:
【题目】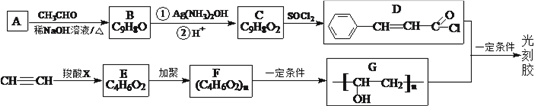
己知: 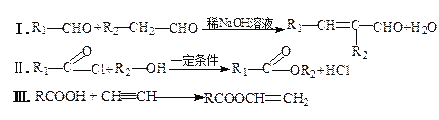
请回答下列问题:
(1)A的名称是_____________。E中所含官能团的名称是________________。
(2)C→D的反应类型是_____________,X的结构简式为________________。
(3)D +G→光刻胶的化学方程式为_____________________________________。
(4)T是C的同分异构体,T具有下列性质或特征:①能发生水解反应和银镜反应;②能使溴水褪色;③属于芳香族化合物。则T的结构有___________种,其中核磁共振氢谱为5组峰,且峰面积比为1:1:2:2:2的结构简式为______________(已知:C=C—OH不稳定)。
(5)根据自己已学知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2COOH的合成路线流程图(无机试剂任选)___________________。(合成路线流程图示例:CH2 =CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH)
CH3CH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素在元素周期表中位于______________。
(2)用化学方程式表示工业制备铝单质______________。 铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。

(3) 该铝热反应的化学方程式是______________。铝热反应的反应现象说明反应物的总能量___________生成物的总能量(填“<”、“>”或“=”)。
(4)铝热反应在工业上用于冶炼______________金属(填编号)。
A. 强还原性 B. 难熔性 C. 易导电 D. 活泼
(5)反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此 固体中含有金属铝:取少量固体于试管中,滴加______________,当观察到______________现象时,证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Mg2+、Ba2+、CO32﹣、SO42﹣、Cl﹣,现取三份100mL溶液进行如下实验:根据上述实验,以下推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量KOH溶液加热后,收集到气体0.08mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
A. Na+一定存在
B. 100mL溶液中含0.01mol CO32﹣
C. Cl﹣一定存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的( )
A. 次氯酸钠溶液中通入少量二氧化硫气体:2ClO﹣+SO2+H2O═2HClO+SO ![]()
B. 向NaAlO2溶液中通过量CO2:AlO ![]() +CO2+H2O═Al(OH)3↓+CO
+CO2+H2O═Al(OH)3↓+CO ![]()
C. 电路板腐蚀液中的反应:Cu+2Fe3+═2Fe2++Cu2+
D. 小苏打溶液与NaOH溶液混合:HCO ![]() +OH﹣═CO2↑+H2O
+OH﹣═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下:
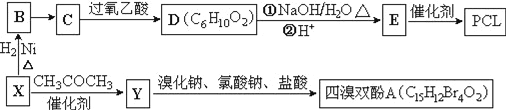
已知:①X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为![]() 。
。
②![]() 。
。
③RCOCH2R′![]() RCOOCH2R′。
RCOOCH2R′。
(1)B的名称是_________________。
(2)B→C还需要的反应试剂及条件是___________。C→D的反应类型是______________________。
(3)写出X→Y的化学方程式:_______________________________。
(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗__molNaOH。
(5)符合以下条件的D的同分异构体有__种(不考虑空间异构)。
①含有两个甲基和两种官能团 ②能使溴的CCl4溶液褪色 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为:
![]()
利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图:________________________________。
,写出合成该涂料的反应流程图:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一定温度下的某恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是
2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是
A. 增加c(NO),平衡逆向移动,反应的化学平衡常数减小
B. 100s 内NO2的分解速率为8×10-3 mol/(L·s)
C. 反应达平衡时,吸收的热量为0.2Q
D. 其他条件不变时,若开始时n(NO2)为2.4 mol,则达到平衡后,c(O2)<c(NO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性纳米四氧化三铁在催化剂、DNA检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米Fe3O4的流程如下:

(1)Ⅱ中的反应温度需控制在50℃~60℃之间,实验室控制该温度的最佳方法是____。
(2)Ⅱ中生成Fe3O4的离子方程式是__________。
(3)操作Ⅲ包含的方法有______。
(4)检验Fe3O4中含有+2价铁元素的方法是______。
(5)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米Fe3O4,当混合溶液中n(Fe3+)∶n(Fe2+)=1∶1时,容易得到理想的纳米Fe3O4。
① 实际制备时选择n(Fe3+)∶n(Fe2+)小于2∶1,原因是_____。
② 该实验室无FeCl2溶液,现用5mLFeCl3溶液制备Fe3O4,配制n(Fe3+)∶n(Fe2+)=1∶1混合溶液的方法是____________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com