
(1)NaHCO3和NaHSO4的溶液混合后,实际参加反应的离子是________。
(2)实验室中不能用硫化钠溶液和氯化铝溶液混合来制取硫化铝,原因是______
(用化学方程式表示)。
(3)溶液中SO32-与H+不能大量共存,是因为发生了_________反应,酸性条件下NO3-与Fe2+不能大量共存,是因为发生了_________反应(填反应类型)。
(4)只选用一种试剂就能把浓度均为1 mol·L-1的Na2SO4、Na2SO3、Na2CO3、BaCl2溶液加以区别,这种试剂是。
A.CaCl2 B.AgNO3 C.H2SO4 D.NaOH
(1)水溶液中NaHCO3电离出Na+、HCO3-, NaHSO4电离出Na+、H+、SO42-。
(2)硫化钠溶液和氯化铝溶液混合后Al3+与S2-发生水解相互促进的反应:3Na2S+2AlCl3+6H2O====2Al(OH)3↓+6NaCl+3H2S↑
(3)SO32-与H+发生复分解反应,酸性条件下NO3-与Fe2+发生氧化还原反应。
(4)H2SO4与Na2SO4不反应;与Na2SO3反应产生刺激性气味的气体;与Na2CO3反应产生无色无味的气体;与BaCl2反应产生白色沉淀。
答案:(1)HCO3-和H+
(2)3Na2S+2AlCl3+6H2O====2Al(OH)3↓+6NaCl+3H2S↑
(3)复分解 氧化还原
(4)C


科目:高中化学 来源: 题型:
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl—)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是( )
A.原溶液的浓度为0.1mol/L B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+) D.原溶液中c(Br-)=0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是 ( )
A.实验室中用稀硫酸与锌粒反应制取 H2 B.实验室中用高锰酸钾加热分解制取 O2
C.实验室中用浓盐酸与二氧化锰加热制取Cl2 D.实验室中用稀盐酸与石灰石反应制取CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,溶液颜色无明显变化的是( )
A.KI溶液中滴入淀粉溶液
B.往FeCl2溶液中通入氯气
C.显红色的酚酞溶液中加入过量盐酸
D.往酸性高锰酸钾溶液中通入足量二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
在常压和500℃时把O2和SO2按1∶2体积比混合,如果混合前O2为10 mol,平衡混合气体中SO3占总体积的91%。求:
(1)平衡时有多少摩尔O2?
(2)混合气体中SO2占总体积的体积分数是多少?
(3)SO2的转化率是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中给CO(g)和H2O(g)的混合物加热到800℃时,有下列平衡:CO(g)+H2O(g)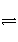
 CO2(g)+H2(g)且K=1。若用2 mol CO(g)和10 mol H2O(g)相互混合并加热至800 °C,则CO的转化率为________。
CO2(g)+H2(g)且K=1。若用2 mol CO(g)和10 mol H2O(g)相互混合并加热至800 °C,则CO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两只容器中分别充入等量的体积比为2∶1的SO2与O2的混合气体,并使A和B容积相等(如图)。在保持400℃的条件下使之发生如下反应:2SO2(g)+O2(g)
 2SO3(g),填写下列空格。
2SO3(g),填写下列空格。
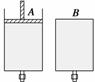
(1)达到平衡时所需的时间A容器比B容器____,A容器中SO2的转化率比B容器________。
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,A容器化学平衡____________移动,B容器化学平衡________移动。
(3)达到(1)所述平衡时,若向两容器中通入等量的原反应气体,达到平衡时,A容器中SO3的体积分数比原平衡______(选填“增大”、“减小”或“不变”);B容器中SO3的体积分数比原容器________(选填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com