
下列离子方程式正确的是
A.氧化铁和盐酸:O2-+2H+=H2O
B.向澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
C.澄清石灰水和Ca(HCO3)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.氢氧化钡溶液和硫酸镁溶液反应:Ba2++SO42-=BaSO4↓
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高一上期中化学卷(解析版) 题型:选择题
将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
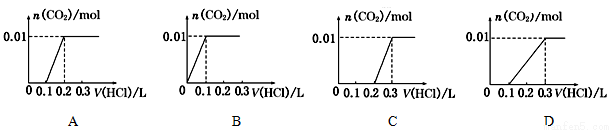
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高一上期中化学卷(解析版) 题型:选择题
在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是
A.Na+、Ag+、CO32-、Cl- B.K+、 Ba2+、 SO42-、Cl-
C.Na+、K+、CO32-、Cl- D.Na+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上期中化学卷(解析版) 题型:推断题
A、B、C、D、E五瓶透明溶液,分别是Na2CO3、BaCl2、HCl、NaHSO4、AgNO3中的一种。
①A与D反应有气体生成;
②A与E反应有沉淀生成;
③B与E反应有沉淀生成;
④B与C反应有沉淀生成 ;
⑤C与D反应有气体生成;
⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)B与D反应的离子方程式为_________________________。
A与D反应的离子方程式为______________________________。
(2)向一定量的Ba(HCO3)2溶液中,逐滴加入C溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为: ,沉淀完全后,继续滴加C溶液,此时发生反应的离子方程式为: 。
(3)向C溶液中加入Zn粒,反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上期中化学卷(解析版) 题型:选择题
室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl, 恢复到原温度后,下列判断正确的是
恢复到原温度后,下列判断正确的是

A.开始时左右两室分子数相同
B.最终容器内无H2存在
C.反应前后H2室压强相同
D.最终容器内密度与原来相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上期中化学卷(解析版) 题型:选择题
为提纯下列物质(括号内为杂质),选用的试剂和分离方法不正确的是
物质 | 试剂 | 分离方法 | |
A | 淀粉溶液(NaCl) | 水 | 渗析 |
B | CaCO3(CaO) | 水 | 过滤 |
C | KCl溶液(I2) | 酒精 | 萃取 |
D | CO2(HCl) | 饱和碳酸氢钠溶液 | 洗 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高二上期中化学卷(解析版) 题型:实验题
I、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入1或2滴酚酞溶液
⑤滴入一滴标准液后,溶液颜色由无色变为红色立即停止滴定,记录液面读数
请回答:
(1)以上步骤有错误的是(填编号) 。
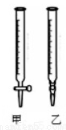
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_________中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:_________(填编号)
A.酸式滴定管未润洗
B.滴定前,滴定管尖嘴无气泡,滴定后有气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.滴定结束时仰视滴定管,并记录数据
E.滴定过程中有一滴标准液飞溅出锥形瓶
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼 睛注视 。
睛注视 。
II.利用中和滴定的原理,在工业生产中还可以进行氧化还原滴定测定物质含量。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉状TiO2。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(5)除去TiCl4含有的杂质A3+可选用调节pH的方法使其转化为A(OH)3沉淀除去。已知Al(OH)3的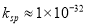 ,若想将Al3+完全沉淀(不考虑钛离子的沉淀),则溶液的pH一定不能小于__________。(
,若想将Al3+完全沉淀(不考虑钛离子的沉淀),则溶液的pH一定不能小于__________。( 时,即可认为完全沉淀)
时,即可认为完全沉淀)
(6)TiCl4水解生成TiO2·xH2O的化学方程式为__________________________。
(7)滴定终点的现象是___________________________。
(8)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高二上期中化学卷(解析版) 题型:选择题
对已达到化学平衡的反应2A(g)+3B(s) 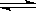 2C(g),增大压强时,对反应产生的影响是( )
2C(g),增大压强时,对反应产生的影响是( )
A.正反应速率增大,逆反应速率减小,平衡向正向移动
B.逆反应速率增大,正反应速率减小,平衡逆向移动
C.正、逆反应速率都增大,平衡不移动
D.正、逆反应速率都增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中必修化学卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.22.4L氢气中含有的氢分子数目为NA
B.0.5molNa2CO3中含有的Na+数目为0.5NA
C.常温常压下,14g氮气含有的原子数目为NA
D.0.5mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com